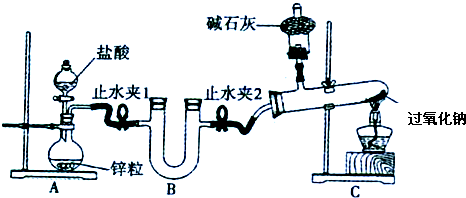
题目内容
在反应Na+H2O═NaOH+H2↑中氧化剂是
配平方程式并用单线桥表示此反应电子转移的方向和数目: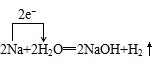
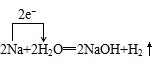 .
.
H2O
H2O
,氧化产物是NaOH
NaOH
,生成33.6LH2 (标准状况下)时转移电子数为3NA
3NA
.配平方程式并用单线桥表示此反应电子转移的方向和数目:
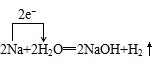
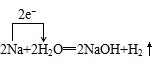
分析:根据化合价的升降判断氧化剂、还原剂以及氧化产物和还原产物;利用电子的转移与气体的关系计算生成一定量的气体时电子转移的量,氧化还原反应中,化合价升高元素失电子,化合价降低元素得到电子,化合价升高值=化合价降低值=转移电子数.
解答:解:在反应2Na+2H2O═2NaOH+H2↑中,化合价降低的元素是H元素,所在的反应物H2O为该反应的氧化剂,化合价升高的元素是Na元素,所在的反应物金属钠为还原剂,对应产物NaOH是氧化产物,化合价升高值=化合价降低值=转移电子数=2,即该反应转移电子为2mol时,生成氢气的量为1mol,所以当生成33.6LH2 (标准状况下)即1.5mol氢气时,转移电子为3mol,即3NA个,电子转移情况如下: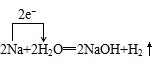 ,
,
故答案为:H2O,NaOH,3NA,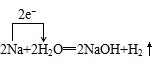 .
.
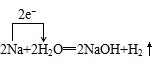 ,
,故答案为:H2O,NaOH,3NA,
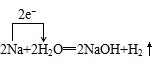 .
.点评:本题考查学生氧化还原反应的有关知识,是对教材知识的考查,难度不大.

练习册系列答案
相关题目