题目内容
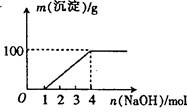
某澄清透明溶液中只可能含有①Al3+;② Mg2+;③Fe3+;④Fe2+;⑤H+;⑥CO32+;⑦NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是:( )

| A.②⑤⑥⑦ | B.②③⑤⑦ |
| C.①②③⑥⑦ | D.①②③④⑤⑦ |
B
试题分析:向该溶液中加入NaOH溶液的过程中,开始没有沉淀,说明溶液呈酸性,则一定含有大量的H+离子,在酸性溶液中CO32-离子与H+离子反应生成CO2气体而不能存在,根据溶液的电中性可知一定含有阴离子,则一定含有NO3-离子;而后才有沉淀,能够生成沉淀的是Fe3+、Fe2+或Al3+或Mg2+中的一种或几种,但在酸性条件下Fe2+离子与NO3-离子发生氧化还原反应而不能共存,则一定不含Fe2+离子,沉淀达最大量后继续滴加NaOH溶液沉淀不减少消失.说明一定不含有Al3+;在NaOH溶液为4mol时,若沉淀全部是Mg(OH)2质量为87g,若全部为氢氧化铁则质量为107g,根据图像可知沉淀完全是质量为100g,说明溶液一定是含有②Mg2+;③Fe3,综上所述,溶液中一定含有H+离子、NO3-离子,一定没有AlO2-、CO32-、Fe2+离子,一定含有Fe3+、Mg2+;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2
2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2