题目内容
常温下,下列叙述错误的是( )
分析:A.加水稀释醋酸促进醋酸电离,向醋酸溶液中通入氯化氢气体,则抑制醋酸电离;
B.0.1mol?L-1的醋酸钠溶液20mL与0.1mol?L-1盐酸10mL混合后,溶液中存在等物质的量浓度的醋酸、醋酸钠和氯化钠,根据溶液的酸碱性及电荷守恒判断;
C.pH=4的醋酸与pH=10的氢氧化钠溶液中,c(CH3COOH)>c(NaOH)=10-4 mol/L,根据酸碱的物质的量相对大小确定溶液的酸碱性;
D.0.1mol?L-1某一元酸HA溶液中
=1×10-8,结合水的离子积常数计算氢氧根离子浓度,酸中的氢氧根离子浓度等于水电离出的氢离子浓度.
B.0.1mol?L-1的醋酸钠溶液20mL与0.1mol?L-1盐酸10mL混合后,溶液中存在等物质的量浓度的醋酸、醋酸钠和氯化钠,根据溶液的酸碱性及电荷守恒判断;
C.pH=4的醋酸与pH=10的氢氧化钠溶液中,c(CH3COOH)>c(NaOH)=10-4 mol/L,根据酸碱的物质的量相对大小确定溶液的酸碱性;
D.0.1mol?L-1某一元酸HA溶液中
| c(OH-) |
| c(H+) |
解答:解:A.加水稀释醋酸促进醋酸电离,则氢离子的物质的量增大,醋酸分子的物质的量减小,所以使
值增大;向醋酸溶液中通入氯化氢气体,氢离子浓度增大而抑制醋酸电离,则
=
变大,故A正确;
B.0.1mol?L-1的醋酸钠溶液20mL与0.1mol?L-1盐酸10mL混合后,溶液中存在等物质的量浓度的醋酸、醋酸钠和氯化钠,溶液呈酸性则说明醋酸的电离程度大于醋酸根离子的水解程度,醋酸是弱电解质,电离程度较小,所以混合溶液中c(CH3COOH)>c(H+),故B错误;
C.pH=4的醋酸与pH=10的氢氧化钠溶液中,c(CH3COOH)>c(NaOH)=10-4 mol/L,如果两种溶液等体积混合,则醋酸的物质的量大于氢氧化钠,所以混合溶液呈酸性,故C正确;
D..0.1mol?L-1某一元酸HA溶液中
=1×10-8,c(H+).c(OH-)=10 -14,所以c(OH-)=1×10-11mol?L-1,酸中的氢氧根离子浓度等于水电离出的氢离子浓度,所以该溶液中由水电离出的c(H+)=1×10-11mol?L-1,故D正确;
故选B.
| c(H+) |
| c(CH3COOH) |
| c(H+) |
| c(CH3COOH) |
| K电离平衡常数 |
| c(CH3COO-) |
B.0.1mol?L-1的醋酸钠溶液20mL与0.1mol?L-1盐酸10mL混合后,溶液中存在等物质的量浓度的醋酸、醋酸钠和氯化钠,溶液呈酸性则说明醋酸的电离程度大于醋酸根离子的水解程度,醋酸是弱电解质,电离程度较小,所以混合溶液中c(CH3COOH)>c(H+),故B错误;
C.pH=4的醋酸与pH=10的氢氧化钠溶液中,c(CH3COOH)>c(NaOH)=10-4 mol/L,如果两种溶液等体积混合,则醋酸的物质的量大于氢氧化钠,所以混合溶液呈酸性,故C正确;
D..0.1mol?L-1某一元酸HA溶液中
| c(OH-) |
| c(H+) |
故选B.
点评:本题考查酸碱混合溶液定性判断,易错选项是D,注意该酸中氢离子浓度和水电离出的氢离子浓度的区别,为易错点.

练习册系列答案
相关题目

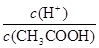 值增大
值增大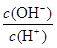 =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L
=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L