题目内容
【题目】已知A为中学化学中的一种盐,B、C为日常生活中常见的金属,离子有相同化合价。通常条件下D为无色无味气体,无色气体G遇空气变红棕色。已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液。各物质之间的转化关系如下图(部分反应产物已略去)。

请回答下列问题:
(1)A的化学式为__________。
(2)A溶液与Na 2 O 2 反应的总化学方程式为__________。
(3)E的稀溶液与F溶液反应的离子方程式为__________。
(4)若向100mL盐A的溶液中加入10g金属单质B的粉末,充分搅拌后,过滤,烘干得10.16g固体,则滤液中溶质的物质的量浓度为__________。(假设溶液体积不变)
【答案】(1)Cu(NO3)2
(2)2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2↓+4NaNO3+O2↑
(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O(4)0.2mol/L
【解析】
试题分析:(1)电解A溶液时产生金属单质C和另外一种气体D,应为电解含氧酸盐溶液,在阴极上析出不活泼金属,则C应为铜,D为氧气,E溶液能与C金属发生氧化还原反应,且E溶液与F溶液也能反应生成无色无味气体G,无色气体G遇空气变红棕色,G为NO,说明E溶液应为硝酸,故A为硝酸铜,C为铜,D为氧气, F与硝酸反应生成NO,说明且含有金属B元素,说明F溶液具有还原性,应为Fe(NO3)2溶液,B为Fe,H为Fe(NO3)3;(2)Na2O2与水加入到Cu(NO3)2溶液中反应生成NaOH和氧气,NaOH和Cu(NO3)2反应生成蓝色沉淀2Cu(OH)2,方程式为2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2↓+4NaNO3+O2↑;(3)硝酸具有强氧化性,Fe2+具有还原性,二者发生氧化还原反应,反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(4)滤液中溶质的物质的量浓度为c
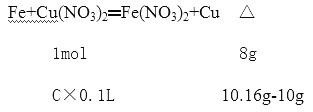
C=0.2 mol/L。

【题目】下列除杂试剂和方法不正确的是
编号 | 被提纯物质(杂质) | 除杂试剂 | 分离方法 |
A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
B | 乙烯(二氧化硫) | 氢氧化钠溶液 | 洗气 |
C | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
D | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
A. A B. B C. C D. D