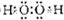题目内容
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。

(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
A.M、X、Z形成的单质熔沸点 M>X>Z
B.氢化物的热稳定性:W>X
C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同
D.Z元素含氧酸的酸性一定强于Y元素的含氧酸
(3)元素W与M按原子个数比1:1形成的化合物A的电子式为______________。
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
(1)第三周期第IVA族(1+1分);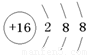 (2分)
(2分)
(2)B(2分)
(3)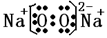 (2分)
(2分)
(4)极性(2分)
(5)HF(2分)
(6)Al3+ + 3AlO2﹣+ 6H2O = 4Al(OH)3↓(2分)
【解析】
试题分析:(1)X单质是一种半导体材料,所以X为硅元素,Y的最外层电子数是最内层电子数的三倍又在硅元素后面,所以Y是硫元素;
(2)推断W为氧,M是钠,N是铝,X是硅,Y是硫,Z是氯,A、M、X、Z形成的单质熔沸点X>M>Z,错误;B、正确;C、硅和氧形成的是共价键,硅和氯形成的是离子键,错误;D、盐酸的酸性没有硫酸的强,错误。
(3)过氧化钠中既有共价键也有离子键;
(4)氯元素以离子键与别的元素结合,含有离子键,所以为极性分子;
(5)卤素氢化物的水溶性HF>HCl>HBr>HI;
(6)铝离子和偏铝酸根离子能发生双水解。
考点:常见的短周期元素。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案