题目内容
已知盐酸参加的下列三个反应:
①CaCO3+2HCl═CaCl2+CO2↑+H2O ②Fe+2HCl═FeCl2+H2↑ ③MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(1)判断上述三个反应中属于氧化还原反应的是
(2)上述反应说明盐酸具有
①CaCO3+2HCl═CaCl2+CO2↑+H2O ②Fe+2HCl═FeCl2+H2↑ ③MnO2+4HCl(浓)
| ||
(1)判断上述三个反应中属于氧化还原反应的是
②③
②③
,其中盐酸作还原剂的是③
③
.(2)上述反应说明盐酸具有
酸
酸
性,氧化
氧化
性,还原
还原
性.分析:(1)有电子转移的化学反应是氧化还原反应,失电子化合价升高的反应物是还原剂;
(2)根据各反应酸中各元素化合价变化来确定其性质.
(2)根据各反应酸中各元素化合价变化来确定其性质.
解答:解:(1)①CaCO3+2HCl═CaCl2+CO2↑+H2O中,各元素化合价都不变,所以不是氧化还原反应,为复分解反应,
②Fe+2HCl═FeCl2+H2↑中,铁失电子化合价升高,盐酸中氢元素得电子化合价降低,所以该反应是氧化还原反应,盐酸作氧化剂,
③MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中锰元素得电子化合价降低,氯元素失电子化合价升高,所以该反应是氧化还原反应,且盐酸是还原剂,故答案为:②③;③;
(2)通过(1)知,①中盐酸起酸作用,②中盐酸作氧化剂,③中盐酸作还原剂,故答案为:酸;氧化;还原.
②Fe+2HCl═FeCl2+H2↑中,铁失电子化合价升高,盐酸中氢元素得电子化合价降低,所以该反应是氧化还原反应,盐酸作氧化剂,
③MnO2+4HCl(浓)
| ||
(2)通过(1)知,①中盐酸起酸作用,②中盐酸作氧化剂,③中盐酸作还原剂,故答案为:酸;氧化;还原.
点评:本题考查氧化还原反应,明确元素化合价变化是解本题根据,根据元素化合价升高还是降低判断其性质.

练习册系列答案
相关题目
 MnCl2
+ Cl2↑ + 2H2O
MnCl2
+ Cl2↑ + 2H2O MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O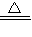 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O