题目内容
11.下列离子反应方程式中,正确的是( )| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 二氧化碳与水反应 CO2+H2O═2H++CO32- | |
| C. | 碳酸钡与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钠溶液与硫酸铜溶液反应2OH-+Cu2+═Cu(OH)2↓ |
分析 A.铁与稀硫酸反应生成的是亚铁离子,不是铁离子;
B.二氧化碳和水反应生成的碳酸为弱酸;
C.碳酸钡难溶于水不能拆分成离子;
D.氢氧化钠溶液与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,实质是铜离子结合氢氧根离子生成氢氧化铜沉淀的过程;
解答 解:A.铁与稀硫酸反应生成硫酸亚铁,反应的离子方程式为:Fe+2H+=Fe2++H2↑,故A错误;
B.二氧化碳与水反应 CO2+H2O═H2CO3,故B错误;
C.碳酸钡与盐酸反应的离子方程式为:BaCO3+2H+═H2O+CO2↑+Ba2+,故C错误;
D.氢氧化钠溶液与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,反应的离子方程式为:2OH-+Cu2+═Cu(OH)2↓,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | “地沟油”禁止食用,但经加工处理后可用来制造肥皂和生物柴油 | |
| B. | 白铁(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 | |
| C. | 牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0KJ/mol |
19. 某同学按如图所示的装置做实验,并记录实验情况.你认为框内叙述合理的是( )
某同学按如图所示的装置做实验,并记录实验情况.你认为框内叙述合理的是( )
①锌为正极,铜为负极?
②电解质溶液的pH不变?
③电流表的指针发生偏转?
④铜极上有气泡产生?
⑤锌极上仍有少量气泡产生?
⑥溶液中的阳离子向负极移动.
 某同学按如图所示的装置做实验,并记录实验情况.你认为框内叙述合理的是( )
某同学按如图所示的装置做实验,并记录实验情况.你认为框内叙述合理的是( ) ①锌为正极,铜为负极?
②电解质溶液的pH不变?
③电流表的指针发生偏转?
④铜极上有气泡产生?
⑤锌极上仍有少量气泡产生?
⑥溶液中的阳离子向负极移动.
| A. | ①②③ | B. | ③④⑤ | C. | ③④⑥ | D. | ②③④ |
6.下列物质能通过化合反应直接制得的是( )
①FeCl2 ②Fe(OH)3 ③NH4NO3 ④HCl.
①FeCl2 ②Fe(OH)3 ③NH4NO3 ④HCl.
| A. | 只有①②③ | B. | 只有②③ | C. | 只有①③④ | D. | 全部 |
16.设NA 表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N A | |
| D. | 常温常压下,2.24L CO 和CO2 混合气体中含有的碳原子数目为0.1NA |
3.X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是( )
| A. | X:3s23p1 Y:3s23p4 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p5 | D. | X:2s22p3 Y:1s1 |
20.下列三种有机物是某些药物中的有效成分:

以下说法正确的是( )

以下说法正确的是( )
| A. | 将各1mol的三种物质分别与氢氧化钠溶液充分反应,阿司匹林消耗氢氧化钠最多 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种有机物中的所有原子不可能共平面 | |
| D. | 三种有机物都能与浓溴水发生反应 |
15.下列实验中,对应的现象以及结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| 向淀粉水解后的溶液中加入碘水 | 溶液变蓝色 | 淀粉没有水解 | |
| 将苯滴入溴水中,振荡,静置 | 溴水层褪色 | 溴和苯发生加成反应 | |
| 向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 | |
| 相同的铝片分别与同温同体积,且c(H+)=1mol•L-1的盐酸、硫酸反应 | 铝与盐酸反应产生气泡较快 | 可能是Cl-对该反应起到促进作用 |
| A. | A | B. | B | C. | C | D. | D |
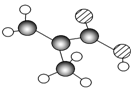 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
. .
.