题目内容
8.(1)某温度(t℃)时,水的离子积为KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)大于25℃.若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:①若所得混合液为中性,则a:b=10:1.
②若所得混合液的pH=2,则a:b=9:2.
(2)常温下,0.1mol•L-1HA溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=108.现取0.1mol•L-1HA溶液与PH=13的NaOH溶液等体积混合(忽略混合后溶液体积的变化).混合后溶液呈碱性(填“酸”“碱”或“中”),该混合溶液中由水电离出的c(H+)大于0.1mol•L-1NaOH溶液中由水电离出的c(H+)(填“大于”﹑“小于”或“等于”).
(3)已知NaB水溶液呈碱性,常温下将0.10mol NaB和0.05mol HCI溶于水,得到1L溶液.
①已知该混合溶液为弱酸性,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(B-)>c(Cl-)>c(H+)>c(OH-);
②向上述混合液中再加入0.03mol NaOH,溶液中n(B-)+n(OH-)-n(H+)=0.08 mol.
分析 (1)水的电离是吸热反应,升高温度促进水电离;该温度下,pH=11的NaOH溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L,如果混合溶液呈中性,则n(OH-)=c(H+);
如果混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,c(H+)=$\frac{c({H}^{+})V({H}^{+})-c(O{H}^{-})V(O{H}^{-})}{V({H}^{+})+V(O{H}^{-})}$;
(2)含有弱根离子的盐能促进水电离,酸或碱能抑制水电离,据此解答即可;
(3)①NaA水溶液呈碱性,说明A-离子水解,HA是弱酸,常温下将0.10molNaA和0.05molHCl溶于水,发生反应,NaA+HCl=NaCl+HA,依据定量计算得到溶液中含有0.05molNaA,得0.05molHA,0.05molNaCl;得到pH<7的溶液,说明溶液呈酸性,同浓度溶液中HA电离大于A-离子的水解;依据溶液中电荷守恒,电荷守恒,酸碱性分别计算分析判断;
②根据电荷守恒可得n(A-)+n(OH-)-n(H+)=c(Na+)-c(Cl-),然后根据钠离子、氯离子总物质的量进行计算.
解答 解:(1)水的电离是吸热反应,升高温度促进水电离,t℃时水的离子积为1×10-13>1×10-14,则该温度大于25℃;
该温度下,pH=11的NaOH溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L,如果混合溶液呈中性,则n(OH-)=c(H+),所以0.01mol/L×aL=0.1mol/L×bL,a:b=10:1;
如果混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,c(H+)=$\frac{c({H}^{+})V({H}^{+})-c(O{H}^{-})V(O{H}^{-})}{V({H}^{+})+V(O{H}^{-})}$=$\frac{0.1mol/L×bL-0.01mol/L×aL}{aL+bL}$=0.01mol/L,a:b=9:2,
故答案为:大于; ①10:1 ②9:2;
(2)0.1mol•L-1HA溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=108,c(H+)×c(OH-)=1×10-14,解得c(H+)=10-3<10-1,那么HA为弱酸,取0.1mol•L-1HA溶液与PH=13的NaOH溶液等体积混合,此时溶液恰好为NaA,为强碱弱酸盐,水解呈碱性;含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1mol•L-1NaOH溶液中由水电离出的c(H+),故答案为:碱; 大于;
(3)①常温下将0.10mol NaB和0.05mol HCl溶于水,得到1L溶液,得到的溶液中含有0.05molNaB、0.05molHB、0.05molNaCl;溶液的pH<7,说明溶液呈酸性,同浓度溶液中HB电离大于B-离子的水解,c(B-)>c(Cl-)、c(H+)>c(OH-),则溶液中离子浓度大小为c(Na+)>c(B-)>c(Cl-)>c(H+)>c(OH-),
故答案为:c(Na+)>c(B-)>c(Cl-)>c(H+)>c(OH-);
②根据混合液中电荷守恒可得:n(A-)+n(OH-)+c(Cl-)=c(Na+)+n(H+),则n(A-)+n(OH-)-n(H+)=c(Na+)-c(Cl-)=0.03mol+0.10nol-0.05mol=0.08mol,故答案为:0.08.
点评 本题考查了弱电解质的电离及其影响、溶液中离子浓度大小比较,题目难度中等,注意掌握影响弱电解质的电离平衡的因素,能够根据电荷守恒、物料守恒、盐的水解判断溶液中各离子浓度大小,试题培养了学生灵活应用所学知识的能力.

 优百分课时互动系列答案
优百分课时互动系列答案| A. | NaHS溶液的水解方程式:HS-+H2O?H3O++S2- | |
| B. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| C. | 向KAl(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
 Na2CO3溶液中含碳元素微粒有多种,常温下,这些微粒的物质的量分数与溶液pH的变化关系如图所示.下列说法正确的是( )
Na2CO3溶液中含碳元素微粒有多种,常温下,这些微粒的物质的量分数与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | 在滴有酚酞的Na2CO3溶液中逐渐滴加盐酸至溶液恰好变为无色,得到NaHCO3溶液 | |
| B. | 有CO2气体放出的范围是pH≤5 | |
| C. | HCO3-的电离平衡常数为1×10-4 | |
| D. | pH=11的Na2CO3溶液稀释到体积为原来的100倍后pH=9 |
| A. | KMnO4→MnO2 | B. | Na2CO3→CO2 | C. | Fe2+→Fe | D. | CO→CO2 |
(1)二氧化碳的电子式是
 .
.(2)NaOH溶液喷成雾状的目的是增大气液反应物的接触面积,加快反应速率,提高二氧化碳的吸收率.
(3)若使用800mL1.0mol/LNaOH溶液吸收11.2L(标准状况)的CO2.
①反应的离子方程式是5CO2+8OH-=3CO32-+2HCO3-+3H2O.
②用所得溶液中的n(CO32-)、n(H2CO3)、n(H+)、n(OH-)这四个物理量建立一个代数式,使其值为0.3mol,即n(CO32-)-n(H2CO3)-n(H+)+n(OH-)等于0.3mol.
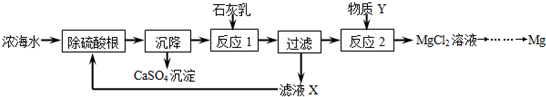
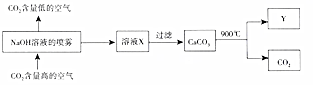
(4)该流程中可循环利用的物质有CaO、NaOH.
(5)某学习小组对碳酸钠和碳酸氢钠溶液进行了实验研究:
| 实验序号 | 实验操作 | 实验现象 |
| 步骤 I | 分别取等体积、等物质的量浓度的碳酸钠和碳酸氢铵溶液,滴加酚酞试液 | 两份溶液均变为红色 |
| 步骤 II | 加热两份溶液 | 溶液颜色均变深 |
| 步骤 III | 将上述两份溶液恢复到室温 | 碳酸钠溶液颜色恢复为原来的深浅;碳酸氢钠溶液的颜色也变浅,但比原先要深 |
②加热碳酸钠溶液,红色变深的原因是升高温度,促进碳酸根离子的水解.
③加热碳酸氢钠溶液,溶液颜色也加深,除与碳酸钠相似的原因外,还可能有的原因是2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑(用化学方程式表示).
| A. | 常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应 | |
| B. | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性 | |
| C. | H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强 | |
| D. | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性 |
 1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
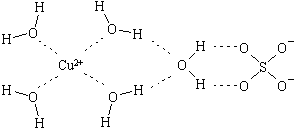
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是水分子间有氢键发生缔合作用.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的分子有CCl4(SiCl4)等(任写一种)
③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有AC(填序号)
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
④写出基态Cu原子的外围电子排布式3d104s1;
金属铜采用面心立方堆积方式,已知Cu原子的半径为r pm,相对原子质量为M,NA表示阿伏加德罗常数,则金属铜的密度是$\frac{4M}{{{N_A}{{(2\sqrt{2}r×{{10}^{-10}})}^3}}}$g/cm3(列出计算式).