题目内容
(14分)在一个装有可移动活塞的容器中模拟传统工业合成氨的反应:N2(g)+3H2(g)
 2NH3(g),反应达到平衡后,测得NH3的物质的量为amol
2NH3(g),反应达到平衡后,测得NH3的物质的量为amol
(1)保持容器内的温度和压强不变,向平衡体系中又通入少量的H2,再次达到平衡后,测得NH3的物质的量为bmol,则 a b(填入“>”或“<”或“=”或“无法确定”,下同)。若向平衡体系中通入的是少量N2,则 a b。
煤制油是一项新兴的、科技含量较高的煤化工技术,发展煤制油对我国而言具有重大意义。下列是煤通过间接液化技术制汽油和丙烯的主要工艺流程图。

已知甲醇制烃的反应原理为:

(2)为了提高原料利用率,上述工艺中应控制合成气中V(CO):V(H2)= 。
(3)由二甲醚在催化剂作用下转化为丙烯的化学方程式为: 。
(4)每生产1t甲醇约耗煤1.5t,每生产1 t汽油约需耗2.4t甲醇,2015年我国煤制油将达到1000万吨,则2015年当年需消耗原煤约 万吨。
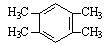
(5)采用MTG法生产的汽油中,均四甲苯(1,2,4,5-四甲基苯)质量分数约占4 %~7%,均四甲苯的结构简式为: 。
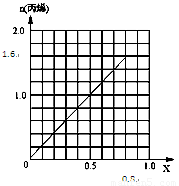
(6)采用DMTO技术,若获得乙烯和丙烯及丁烯3种烃,生成丁烯的选择性(转化丁烯的甲醇的物质的量与甲醇总物质的量之比)为20%,其余生成乙烯和丙烯,设丙烯的选择性为x,今有403.2L(标准状况)合成气,且完全转化为甲醇,甲醇转化为烯烃的总转化率亦为100%,请作出丙烯的物质的量随x变化的曲线。

(每空2分共14分)
(1)a<b 无法确定。
为说明问题方便起见,设原浓度皆为1mol•L-1,加入H2时,H2的浓度增大,设为原浓度的x倍(x>1),N2、NH3的浓度均减小相同倍数,设为原来浓度的y倍(y<1),则Q(浓度商)= y/x3 K(K为平衡常数),所以Q<K,平衡向正反应方向移动,故得。
为说明问题方便起见,设原浓度皆为1mol•L-1,加入N2时,N2的浓度增大,设为原浓度的x倍(x>1),H2、NH3的浓度均减小相同倍数,设为原来浓度的y倍(y<1),则Q(浓度商)= 1/xy K(K为平衡常数),xy可以等于、大于或小于1,所以Q、K大小无法比较,讨论分析如下:若xy=1,则a=b;若xy>1,则a<b;若xy<1,则a>b。
(2)1∶2
(3)3CH3OCH3
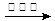 2CH3-CH=CH2
+ 3H2O (4)3600
2CH3-CH=CH2
+ 3H2O (4)3600
(5)
(6)
【解析】

| A、a<b | B、a=b | C、a>b | D、以上均有可能 |
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数的表达式K = ,由上表数据可得,该反应为 反应。(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01 mol·L-1、c(H2O)=0.03mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率 (填"大"、"小"或"不能确定")
③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
①平衡时CH3OH的体积分数w为 。
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
| 容器 | 实验1 | 实验2 | 实验3 |
| 反应物投入量(始态) | 1mol CO2、3mol H2 | 1mol CH3OH、1mol H2O | 2mol CH3OH、2mol H2O |
| CH3OH的平衡浓度/mol·L-1 | C1 | C2 | C3 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ |
| 体系压强/Pa | P1 | P2 | P3 |
| 反应物转化率 | a1 | a2 | a3 |
A.2 C1>C3 B.x+y=49.0 C.2P2<P3
D.(a1+a3)<1 E.2P1>P3 F.a1= a2
③在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。
CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。
 2CA3(g)
2CA3(g)
 2NH3(g),反应达到平衡后,测得NH3的物质的量为amol
2NH3(g),反应达到平衡后,测得NH3的物质的量为amol

