题目内容
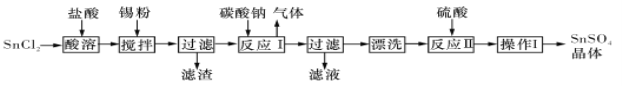
【题目】I.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
A.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
B.SnC12易水解生成碱式氯化亚锡
回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:___________。
(2)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(3)反应I得到沉淀SnO,得到该沉淀的离子反应方程式是____________。
(4)操作I是____________。
II.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L。若在10 mL含有KCl和KI各为0.01 mol/L的溶液中,加入16 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
c(K+)>c(NO![]() )>c(Cl-)>c(Ag+)>c(I-)
)>c(Cl-)>c(Ag+)>c(I-)
B .c(K+)>c(NO![]() )>c(Ag+)>c(Cl-)>c(I-)
)>c(Ag+)>c(Cl-)>c(I-)
C.c(K+)>c(NO![]() )>c(Ag+)=c(Cl-)+c(I-)
)>c(Ag+)=c(Cl-)+c(I-)
D.c(NO![]() )>c(K+)>c(Ag+)>c(Cl-)>c(I-)
)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
【答案】(10分每空2分)
I.(1)SnCl2+H2O![]() Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解
(2)防止Sn2+被氧化; (3)Sn2++CO32-=SnO↓+CO2↑
(4)加热浓缩、冷却结晶、过滤、洗涤; II.A
【解析】
试题分析:I.(1)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O![]() Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(2)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(3)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑;
(4)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到;
II.若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL0.01mol/L AgNO3溶液,首先生成AgI沉淀,
反应后剩余n(Ag+)=0.006L×0.01mol/L=6×10-5mol,继续生成AgCl沉淀,
反应后剩余n(Cl-)=0.01×0.01mol/L-6×10-5mol=4×10-5mol,
c(Cl-)=![]() =1.53×10-3mol/L,
=1.53×10-3mol/L,
浊液中c(Ag+)═![]() =1.02×10-7mol/L,
=1.02×10-7mol/L,
c(I-)═![]() =1.48×10-9mol/L,混合溶液中n(K+)=2×10-4mol,
=1.48×10-9mol/L,混合溶液中n(K+)=2×10-4mol,
n(NO3-)=0.016L×0.01mol/L=1.6×10-4mol,则c(K+)>c(NO3-),
故c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故选A。

 名校课堂系列答案
名校课堂系列答案