题目内容
【题目】下列方案能达到实验目的的是
A. 用碱石灰干燥Cl2B. 用饱和Na2CO3溶液除去CO2中的HCl
C. 用品红溶液鉴别SO2和CO2D. 用焰色反应鉴别KCl和KOH
【答案】C
【解析】
A. 碱石灰能与Cl2反应,不能用碱石灰干燥Cl2,选项A错误;
B. 碳酸能与碳酸钠反应生成碳酸氢钠,故不能用饱和Na2CO3溶液除去CO2中的HCl,选项B错误;
C.二氧化硫具有漂白性可使品红褪色,而二氧化碳不能,则用品红溶液鉴别SO2和CO2两种气体,选项C正确;
D.KCl和KOH都含有钾离子,焰色反应的火焰相同,不能用焰色反应鉴别KCl和KOH,选项D错误;
答案选B。

 阅读快车系列答案
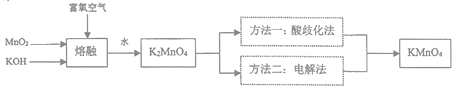
阅读快车系列答案【题目】KMnO4是一种重要的氧化剂,广泛用于化学分析和化工生产以反水处理工业。工业上可由软锰矿(主要成分为MnO2)制备,目前有两种较为成熟的制法。其模拟流程如下图所示:
附表:不同温度下若干常见钾的化合物的溶解度(单位:g/(100gH2O))
化学式 | 20°C | 30°C | 40°C | 60°C | 80°C | 100°C |
CH3COOK | 256 | 283 | 324 | 350 | 381 | |
K2SO4 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 24.1 |
KCl | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 56.3 |
KMnO4 | 6.34 | 9.03 | 12.6 | 22.1 | ||
K2CO3 | 111 | 114 | 117 | 127 | 140 | 156 |
(1)“熔融”时,可用作坩锅材质的是________________(填序号)。
A.氧化铝 B.陶瓷 C.氧化镁 D.石英
(2)写出MnO2和KOH熔融物中通入富氧空气时获得K2MnO4的化学方程式______________________。
(3)“酸歧化法”是在pH<6的情况下K2MnO4即可转化为MnO2和KMnO4,过滤除去MnO2,将滤液经过蒸发浓缩、趁热过滤得到KMnO4粗晶体,再经过重结晶获得较纯净的KMnO4晶体;
①根据表中的溶解度数据以及上述操作的特点,“酸歧化法”不适宜选择的酸性物质是________。
A.稀硫酸 B.醋酸 C.稀盐酸 D.二氧化碳
②“蒸发浓缩”时,温度需控制在70℃,适宜的加热方式是________________。
③根据相关方程式,计算“酸歧化法”的理论产率为_________________。
(4)“电解法”克服了“酸歧化法”理论产率偏低的问题,同时副产品KOH可用于软锰矿的焙烧。电解法制备高锰酸钾的实验装置示意图如下(图中阳离子交换膜只允许K+离子通过)
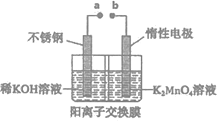
①a为______极(填“正”或“负”),右室发生的电极反应方程式为_______________。
②若电解开始时阳极区溶液为1.0L0.40mol·L-1K2MnO4溶液,电解一段时间后,右室中n(K)/m(Mn)为6:5,阴极区生成KOH的质量为_________________。
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。则下列说法不正确的是
X | Y | |||
W | Z |
A.原子半径大小:Y<XB.W的简单气态氢化物比X的稳定
C.Z的最高价氧化物对应的水化物是一种强酸D.W的单质常用作半导体材料