题目内容
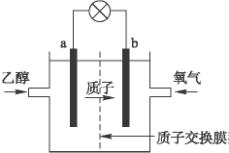
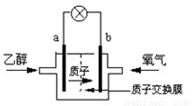
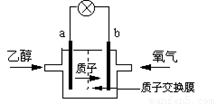
 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图:
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图:(1)
a
a
极(填a或b)为电池的负极,电池工作时电流方向为由b极沿导线到a极
由b极沿导线到a极
;(2)写出电池正极反应方程式
4H++O2+4e-=2H2O
4H++O2+4e-=2H2O
;(3)电池工作时,1mol乙醇被氧化时就有
12
12
mol电子转移.分析:(1)在燃料电池中,燃料在负极发生失电子的反应,电流在电路中从正极流向负极;
(2)在燃料电池中,正极上是氧气得电子的还原反应,根据电解质环境书写电极反应;
(3)根据氧化还原反应中化合价的升降来判断电子的转移.
(2)在燃料电池中,正极上是氧气得电子的还原反应,根据电解质环境书写电极反应;
(3)根据氧化还原反应中化合价的升降来判断电子的转移.
解答:解:(1)在燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,电流在电路中从正极流向负极,故答案为:a;由b极沿导线到a极;
(2)在燃料电池中,正极上是氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:
4H++O2+4e-=2H2O,
故答案为:4H++O2+4e-=2H2O;
(3)根据电池反应:C2H5OH+3O2=2CO2+3H2O,反应转移电子数为12,所以1mol乙醇被氧化时就有12mol电子转移,故答案为:12mol.
(2)在燃料电池中,正极上是氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:
4H++O2+4e-=2H2O,
故答案为:4H++O2+4e-=2H2O;
(3)根据电池反应:C2H5OH+3O2=2CO2+3H2O,反应转移电子数为12,所以1mol乙醇被氧化时就有12mol电子转移,故答案为:12mol.
点评:本题考查学生燃料电池的工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目