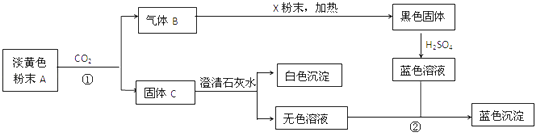
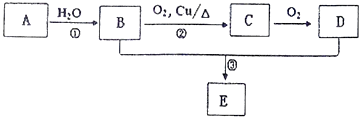
��Ŀ����
����Ŀ��W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ����Ԫ������ǿ������˵����ȷ���ǣ� �� 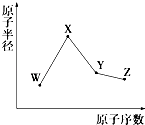
A.��Ӧ�����Ӱ뾶��X��W
B.��Ӧ��̬�⻯����ȶ��ԣ�Y��Z
C.������XZW�Ⱥ����Ӽ����ֺ����ۼ��������������
D.Y���������Z���⻯�������X������������Ӧ��ˮ���ﷴӦ
���𰸡�D
���������⣺W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ�W��һ�ֺ��ص�������Ϊ18��������Ϊ10����֪W��������Ϊ8����W����Ԫ�أ�X��Neԭ�ӵĺ�����������1����ԭ�Ӱ뾶��W��֪XΪ11��Ԫ�أ���XΪNaԪ�أ�Y��ԭ�Ӱ뾶����X��W֮�䣬Y�ĵ�����һ�ֳ����İ뵼����ϣ�����Y��SiԪ�أ�Z�ķǽ�������ͬ����Ԫ������ǿ��ԭ����������Si����ZΪClԪ�أ�
A��O2����Na+���ӵ��Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��O2����Na+ �� ��A����
B���ǽ�����Si��Cl���ǽ�����Խǿ���⻯��Խ�ȶ�����B����
C��������NaClO�Ⱥ����Ӽ����ֺ����ۼ�������ǿ����ʣ���C����
D��Y��������Ϊ�������裬Z���⻯��ΪHCl��X���������Ӧ��ˮ����ΪNaOH��������������ᶼ��������������Һ��Ӧ����D��ȷ��
��ѡD��