题目内容
【题目】A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,C原子最外层电子数是电子层数的3倍,E和C同主族,A、B组成的气态化合物的水溶液呈碱性,D与C能按原子个数比为1∶1或2∶1形成离子化合物。
(1)画出D的原子结构示意图__________,C元素原子的质量数为18,则该核素符号为_________。
(2)A与C形成的化合物中,原子个数比为2∶1的化合物的结构式为________,此化合物与A的单质含有化学键的区别为__________________________________________。
(3)D与C按原子个数比为1∶1形成化合物的电子式是______,含有的化学键为___________。
(4)C、E所形成氢化物的沸点由高到低的顺序是_________>_________(填化学式),原因是____________________________________________________。
【答案】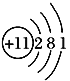
![]() H-O-H H2中为非极性键,H2O中为极性键
H-O-H H2中为非极性键,H2O中为极性键 ![]() 离子键、共价键(或离子键、非极性键) H2O H2S H2O分子间存在氢键,H2S分子间不存在氢键
离子键、共价键(或离子键、非极性键) H2O H2S H2O分子间存在氢键,H2S分子间不存在氢键
【解析】
A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,C原子最外层电子数是电子层数的3倍,C是O,E和C同主族,E是S。A、B组成的气态化合物的水溶液呈碱性,A是H,B是N。D与C能按原子个数比为1∶1或2∶1形成离子化合物,D是Na。
(1)钠的原子结构示意图为 ,C元素原子的质量数为18,则该核素符号为
,C元素原子的质量数为18,则该核素符号为![]() 。(2)A与C形成的化合物中,原子个数比为2∶1的化合物是水,结构式为H-O-H,此化合物与A的单质含有化学键的区别为H2中为非极性键,H2O中为极性键;(3)D与C按原子个数比为1∶1形成化合物是过氧化钠,电子式是
。(2)A与C形成的化合物中,原子个数比为2∶1的化合物是水,结构式为H-O-H,此化合物与A的单质含有化学键的区别为H2中为非极性键,H2O中为极性键;(3)D与C按原子个数比为1∶1形成化合物是过氧化钠,电子式是![]() ,含有的化学键为离子键、共价键(或离子键、非极性键);(4)H2O分子间存在氢键,H2S分子间不存在氢键,所以水的沸点高于硫化氢的沸点。
,含有的化学键为离子键、共价键(或离子键、非极性键);(4)H2O分子间存在氢键,H2S分子间不存在氢键,所以水的沸点高于硫化氢的沸点。