题目内容
16.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是Ar(填元素符号)
(2)②③⑦三种元素的原子半径从大到小的顺序为Cl>N>O (填元素符号)
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式HClO4,碱性最强的化合物的名称氢氧化钾.
(4)元素⑤的氧化物与元素④的最高价氧化物对应水化物反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O
(5)元素⑥和⑦形成的气态氢化物较稳定是HCl(填化学式),用方程式来说明元素⑦的非金属性比⑥的非金属强的事实Cl2+H2S=S↓+2HCl(一个或两个方程式均可)
(6)表示①与⑦形成的化合物的电子式
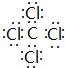 ,写出它的一种用途做溶剂、灭火剂等.
,写出它的一种用途做溶剂、灭火剂等.
分析 由元素在周期表中位置知,①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)稀有气体化学性质最不活泼;
(2)同周期自左而右原子半径减小,电子层越多原子半径越大;
(3)在最高价氧化物的水化物中,酸性最强的化合物是高氯酸,上述元素中K的金属性最强,故氢氧化钾碱性最强;
(4)氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(5)非金属性越强,对应氢化物越稳定;可以利用单质之间相互置换等进行验证;
(6)表示①与⑦形成的化合物为CCl4,可以用作溶剂、灭火剂等.
解答 解:由元素在周期表中位置知,①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,故答案为:Ar;
(2)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Cl>N>O,故答案为:Cl>N>O;
(3)在最高价氧化物的水化物中,酸性最强的化合物是HClO4,上述元素中K的金属性最强,故氢氧化钾碱性最强,故答案为:HClO4;氢氧化钾;
(4)氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(5)非金属性S<Cl,非金属性越强,对应氢化物越稳定,故氢化物稳定性H2S<HCl;可以利用单质之间相互置换等进行验证,反应方程式为Cl2+H2S=S↓+2HCl等,
故答案为:HCl;Cl2+H2S=S↓+2HCl;
(6)表示①与⑦形成的化合物为CCl4,电子式为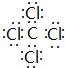 ,可以用作溶剂、灭火剂等,故答案为:
,可以用作溶剂、灭火剂等,故答案为: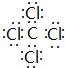 ;做溶剂、灭火剂等.
;做溶剂、灭火剂等.
点评 本题考查元素周期表与元素周期律的关系,题目难度不大,注意金属性、非金属性强弱比较实验事实.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. | 加碘盐就是“I2+NaCl” | B. | 加碘盐就是NaCl中加入KI | ||
| C. | 加碘盐是NaCl中加入少量KIO3 | D. | 加碘盐就是纯KIO3 |
| A. | 所占的体积一定相等 | B. | 所含原子总数相等 | ||
| C. | 所含电子总数相等 | D. | 所含分子数相等 |
| A. | FeS | B. | FeCl3 | C. | Fe3O4 | D. | FeCl2 |
| A. |  石油分馏 | B. | 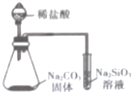 比较非金属性:Cl>C>Si | ||
| C. |  形成原电池 | D. |  铝热反应 |
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
(2)食盐中加碘,这碘指的是元素(填“单质”、“化合物”或“元素”),其中碘元素的化合价为+5.
(3)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.
 ,D原子的原子结构示意图为
,D原子的原子结构示意图为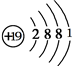 ,C+离子的结构示意图为
,C+离子的结构示意图为 .
. (1)意大利科学家FulvioCacace等获得了极具理论研究意义的N4分子.N4分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,计算1molN4气体转变为N2气体的△H=-882 kJ•mol-1
(1)意大利科学家FulvioCacace等获得了极具理论研究意义的N4分子.N4分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,计算1molN4气体转变为N2气体的△H=-882 kJ•mol-1