题目内容
【题目】Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)工业制漂白粉的化学方程式为 .
(2)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有性.
(3)工业上在80℃时电解氯化钠溶液得到 NaClO3 , 然后与盐酸反应得到ClO2 . 电解时生成ClO3﹣的电极反应式为 .
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液.(已知:2S2O32﹣+I2═S4O62﹣+2I﹣)
Ⅲ.加硫酸调节水样pH至1~3.
操作时,不同pH环境中粒子种类如图所示: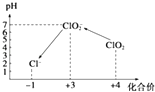
请回答:
①操作Ⅰ中反应的离子方程式是 .
②确定操作Ⅱ完全反应的现象是 .
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是 .
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10﹣3 mol/L的Na2S2O3溶液10mL,则水样中ClO2的浓度是mg/L.
【答案】
(1)2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(2)氧化
(3)Cl﹣+3H2O﹣6e﹣=ClO3﹣+6H+
(4)2ClO2+2I﹣=I2+2ClO2﹣;溶液蓝色褪去,且半分钟内不恢复原色;ClO2﹣+4I﹣+4H+=2I2+Cl﹣+2H2O;0.675
【解析】解:(1)利用氯气与消石灰反应制备漂白粉,反应生成氯化钙、次氯酸钙与水,反应方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,所以答案是:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;(2)反应中Fe、Mn元素化合价升高,被氧化,说明ClO2具有氧化性,
所以答案是:氧化性;(3)工业上在80℃时电解氯化钠溶液得到 NaClO3 , 氯离子发生氧化反应得到ClO3﹣ , 根据O元素守恒,可知有水参加反应,根据电荷守恒可知有氢离子生成,电极反应式为:Cl﹣+3H2O﹣6e﹣=ClO3﹣+6H+ ,
所以答案是:Cl﹣+3H2O﹣6e﹣=ClO3﹣+6H+;(4)①ClO2具有氧化性,加入淀粉后溶液变蓝,说明I﹣被氧化性I2 , 由图可知中性条件下生成ClO2﹣ , 反应离子方程式为:2ClO2+2I﹣=I2+2ClO2﹣ ,
所以答案是:2ClO2+2I﹣=I2+2ClO2﹣;②加入最后一滴Na2S2O3溶液时,溶液蓝色褪去,且半分钟内不恢复原色,说明滴定到终点,
所以答案是:溶液蓝色褪去,且半分钟内不恢复原色;③由图可知,酸性条件下ClO2﹣具有氧化性,将I﹣被氧化性I2 , 自身被还原为Cl﹣ , 反应离子方程式为:ClO2﹣+4I﹣+4H+=2I2+Cl﹣+2H2O,
所以答案是:ClO2﹣+4I﹣+4H+=2I2+Cl﹣+2H2O;④设1L水样中ClO2为xg,则:
2ClO2 | ~~ | I2 | ~~ | 2S2O32﹣ |
135g | 2mol | |||
xg | 1.0×10﹣3 mol/L×0.01mL |
所以135g:xg=2mol:1.0×10﹣3 mol/L×0.01mL
解答x=6.75×10﹣4
则水样中ClO2的浓度是0.675mg/L
所以答案是:0.675.

 阅读快车系列答案
阅读快车系列答案