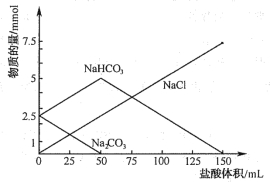
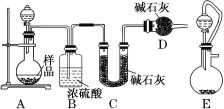
题目内容
【题目】氮及其化合物在生产、生活中有极其重要的作用。
(1)我国长征系列运载火箭用肼(N2H4)作燃料。N2H4与NH3有相似的化学性质。
①写出肼与盐酸反应的离子方程式:_______________。
②在火箭推进剂中装有液态肼和双氧水,当它们混合时迅速反应生成氮气和水蒸气,写出反应的化学方程式:______________。
③火箭发射时以肼为燃料,也可以用一氧化氮作氧化剂,在此反应过程中若转移2 mol电子,则消耗燃料肼的质量为__________。
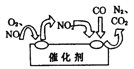
(2)汽车尾气中的氮氧化物是形成酸雨、酸雾的有毒气体之一,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。写出净化过程中总反应的化学方程式:_______________。
【答案】(1)①N2H4+2H+=N2H62+ ②N2H4+2H2O2=N2+4H2O;③16g;
(2)2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
【解析】
试题分析:(1)①类比NH3和H+的反应可得肼与盐酸反应生成N2H62+,反应的离子方程式为N2H4+2H+=N2H62+。
②火箭推进器中,反应物是肼(N2H4)和双氧水(H2O2),生成物是氮气、水,反应的化学方程式为N2H4+2H2O2= N2+4H2O;
③N2H4具有还原性,NO具有氧化性,二者反应生成N2和水,根据质量守恒定律可写出化学方程式为N2H4+2NO=2N2+2H2O,转移4e-,消耗燃料肼1mol,则转移2mol电子,则消耗燃料肼的物质的量是0.5mol,其质量为m=n×M=0.5mol×32g/mol=16g。
(2)净化过程中一氧化氮、一氧化碳和氧气反应生成二氧化碳和氮气,化学方程式为2NO+O2+4CO![]() 4CO2+N2。
4CO2+N2。

 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】I.(1)已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
I1 | I2 | I3 | I4 | |
电离能(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 |
元素M是____________(填写元素符号),该元素属于___________区。
(2)硫原子核外有________种不同运动状态的电子,其基态原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
II.下图为几种晶体或晶胞的示意图:
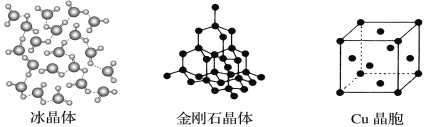
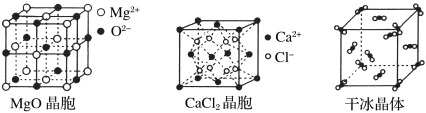
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为__________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“>”或“<”)MgO晶体。
(4)每个Cu晶胞中实际占有____个Cu原子,CaCl2晶体中Ca2+的配位数为____。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是________________________________。