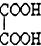题目内容
11.实验室制取氮气的一种方法是在实验装置中引发下列反应:NaNO2+NH4Cl=N2↑+NaCl+2H2O,反应开始时需要加热,然后停止加热反应仍能进行.下列关于该反应的说法正确的是( )| A. | 该反应是放热反应 | |
| B. | 该反应是吸热反应 | |
| C. | 开始时该反应吸热,后来该反应放热 | |
| D. | 上述观点都不正确 |
分析 根据信息:反应开始时需要加热,然后停止加热反应仍能进行来判断反应是一个放热反应.
解答 解:根据提意信息:反应开始时需要加热,这说明反应发生的条件需要加热,然后停止加热反应仍能进行,说明无需加热,反应本身释放的热量就可以满足反应的需要,所以表明反应是一个放热反应,加热时反应发生的一个条件而已.
故选A.
点评 本题考查学生反应吸放热的判断知识,注意有的放热反应也得需要一定的条件才能发生的情况,难度不大.

练习册系列答案
相关题目
1.下列变化一定要加入还原剂才能实现的是( )
| A. | KMnO4→K2MnO4 | B. | HCl→Cl2 | C. | Fe3+→Fe2+ | D. | Na2O→NaOH |
19.下列各组离子在强酸性的溶液中能大量共存,且溶液无色透明的是( )
| A. | Cu2+、Cl-、K+、SO42- | B. | CO32-、Na+、K+、SO42- | ||
| C. | Mg2+、Cl-、K+、NO3- | D. | Ag+、NO3-、K+、Cl- |
6.已知4NH3(g)+5O2(g)?4NO(g)+6H2O(g),若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则正确的关系式为( )
| A. | 2υ(NO)=3υ(H2O) | B. | 5υ(O2)=6υ(H2O) | C. | υ(NH3)=υ(H20) | D. | 5υ(NH3)=4υ(O2) |
16.图为用惰性电极电解NaCl溶液制备盐酸和氢氧化钠的装置图,下列说法正确的是( )
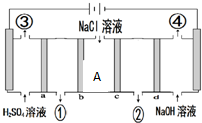

| A. | a和c为阳离子交换膜,b和d为阴离子交换膜 | |
| B. | ③与④两种气体体积比为1:1 | |
| C. | ①处生成的物质为氢氧化钠 | |
| D. | 当转移2mol e-时,A处减少离子数为2NA |
3. 已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
 已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 反应②中的能量变化如右图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
20.下列离子方程式书写正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
1. 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应:
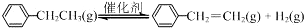
(1)已知:
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
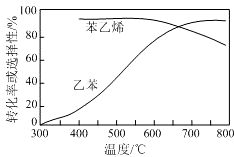
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为 600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用.
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: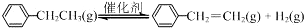
(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol?1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为 600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用.