题目内容
100ml 0.1mol/L Na2SO4溶液和100ml 0.1mol/L BaCl2溶液混合后,Na+浓度约为
- A.0.2mol/L
- B.0.05mol/L
- C.0.1mol/L
- D.不能确定
C
分析:Na2SO4溶液中钠离子的浓度为0.2mol/L,混合后溶液的体积约为两溶液之和,根据稀释定律,混合前后钠离子的物质的量不变,据此计算混合后钠离子的浓度.
解答:0.1mol/L Na2SO4溶液中钠离子的浓度为0.2mol/L.
混合后溶液的体积约为两溶液之和为100ml+100ml=200ml.
令混合后钠离子的浓度为c,根据稀释定律,混合前后钠离子的物质的量不变,则:
100ml×0.2mol/L=200ml×c.
解得:c=0.1mol/L.
故选C.
点评:本题考查物质的量浓度的有关计算,难度不大,可以利用定义式计算,注意基础知识的掌握.
分析:Na2SO4溶液中钠离子的浓度为0.2mol/L,混合后溶液的体积约为两溶液之和,根据稀释定律,混合前后钠离子的物质的量不变,据此计算混合后钠离子的浓度.
解答:0.1mol/L Na2SO4溶液中钠离子的浓度为0.2mol/L.
混合后溶液的体积约为两溶液之和为100ml+100ml=200ml.
令混合后钠离子的浓度为c,根据稀释定律,混合前后钠离子的物质的量不变,则:
100ml×0.2mol/L=200ml×c.
解得:c=0.1mol/L.
故选C.
点评:本题考查物质的量浓度的有关计算,难度不大,可以利用定义式计算,注意基础知识的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列实验装置图所示的实验操作,正确的是( )
A、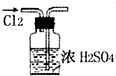 干燥Cl2 | B、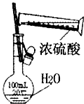 配制100ml 0.1mol?L-1硫酸溶液 | C、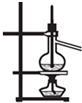 分离沸点相差较大的互溶液体混合物 | D、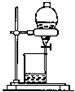 分离互不相溶的两种液体 |
与100mL 0.1mol?L-1 Na2SO4溶液中含有的Na+数目相同的是( )
| A、0.1mol?L-1 NaNO3溶液50mL | B、0.2mol?L-1 NaOH溶液100mL | C、0.2mol?L-1 NaCl溶液50mL | D、0.1mol?L-1 NaHCO3溶液100mL |