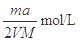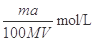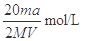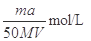题目内容
为测定镁带的纯度,可通过测定镁带与稀硫酸反应生成气体的体积后再进行计算。
(1)用电子天平准确称取纯净的镁带18.000 g,并将其投入到足量的稀硫酸中。完全反应后,在标准状况下可收集到气体__________L。
(2)若镁带中含有锌或铝中的一种杂质。现称取相同的样品进行实验,测得的气体体积(已换算到标准状况)数据列表如下:
测得气体体积的平均值是___________。据此分析,测得的结果比同质量的纯镁产生的气体体积_________(填“多”、“少”或“无影响”)。其原因是含有杂质__________(填“锌”或“铝”)。
(3)利用测得的数据求镁带的纯度。
(1)用电子天平准确称取纯净的镁带18.000 g,并将其投入到足量的稀硫酸中。完全反应后,在标准状况下可收集到气体__________L。
(2)若镁带中含有锌或铝中的一种杂质。现称取相同的样品进行实验,测得的气体体积(已换算到标准状况)数据列表如下:
| 实验次数 | 镁带质量(g) | 测得气体的体积(L) |
| 1 | 18.000 | 16.90 |
| 2 | 18.000 | 17.00 |
(3)利用测得的数据求镁带的纯度。
(1)16.800 (2分)
(2)16.95 多 铝 (各1分,共3 分)
(3)97.33%(4分)
(2)16.95 多 铝 (各1分,共3 分)
(3)97.33%(4分)
试题分析:(1)镁和稀硫酸反应生成氢气和硫酸镁,所以根据方程式Mg+H2SO4=MgSO4+H2↑可知,生成氢气的体积应该是
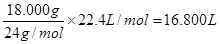 。
。(2)根据表中的数据可知,测得气体体积的平均值(16.90L+17.00L)÷2=16.95L。据此分析,测得的结果比同质量的纯镁产生的气体体积多。由于在质量相同的条件下,铝和稀硫酸反应生成的氢气多,所以含有的杂质应该是铝。
(3)设Mg有x mol,Al有y mol,则:
24x+27y=18.000 x+1.5y=16.95÷22.4 得x=0.73(mol)
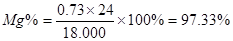
点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和训练的基础上,侧重对学生能力的培养,旨在考查学生灵活运用基础知识解决实际问题的能力。有利于培养学生的逻辑推理能力和规范的答题能力,提高学生的应试能力和学习效率。该题的关键是明确反应的原理,然后结合题意灵活运用即可。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目