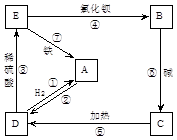题目内容
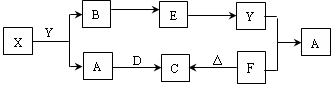
(15分)已知:M、E是中学化学常见金属,A是一种氧化物,可用做颜料。根据下列框图(反应条件和部分物质略去)回答下列问题:

⑴写出M溶于稀H2SO4和H2O2混合液的离子方程式: 。
⑵写出实验室常用来检验X溶液阳离子的操作方法和现象 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
⑷取X溶液,调pH大于7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗1mol I―时,共转移3 mol电子,该反应的离子方程式是 。
(5) K2EO4可用于水源杀菌消毒和净化,原因是________________________________。

⑴写出M溶于稀H2SO4和H2O2混合液的离子方程式: 。
⑵写出实验室常用来检验X溶液阳离子的操作方法和现象 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
⑷取X溶液,调pH大于7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗1mol I―时,共转移3 mol电子,该反应的离子方程式是 。
(5) K2EO4可用于水源杀菌消毒和净化,原因是________________________________。
⑴Cu+2H++H2O2==Cu2++2H2O (3分)
⑵取少许溶液于试管中加入少量KSCN溶液,溶液没有变化,再加入几滴氯水(其他合理也可),溶液变红。(3分)
⑶10KOH + 3Cl2 + 2Fe(OH)3 ="=" 2K2FeO4 + 6KCl + 8H2O (3分)
⑷4Fe2++2I-+3H2O2 +6OH-==I2+4Fe(OH)3 (3分)
(5) K2FeO4中的铁元素具有强氧化性,所以杀菌、消毒;K2FeO4对应的还原产物Fe3+水解生成Fe(OH)3胶体,表面积大,具有吸附作用,所以净水。 (3分)
⑵取少许溶液于试管中加入少量KSCN溶液,溶液没有变化,再加入几滴氯水(其他合理也可),溶液变红。(3分)
⑶10KOH + 3Cl2 + 2Fe(OH)3 ="=" 2K2FeO4 + 6KCl + 8H2O (3分)
⑷4Fe2++2I-+3H2O2 +6OH-==I2+4Fe(OH)3 (3分)
(5) K2FeO4中的铁元素具有强氧化性,所以杀菌、消毒;K2FeO4对应的还原产物Fe3+水解生成Fe(OH)3胶体,表面积大,具有吸附作用,所以净水。 (3分)
试题分析:根据蓝色溶液可推出M为铜,硫酸铜和E发生置换反应可推出E为铁,X为硫酸亚铁Y为硫酸铁Z为氢氧化铁A为氧化铁。
⑵实验室常用来检验硫酸亚铁溶液阳离子的操作方法为取少许溶液于试管中加入少量KSCN溶液,溶液没有变化,再加入几滴氯水,溶液变红。
⑶写出Cl2将氢氧化铁氧化为高铁酸钾、氯化钾和水。
⑷根据溶液呈蓝色并有红褐色沉淀生成,说明产生了淀粉和氢氧化铁沉淀。写出方程式配平即可。
(5)高铁酸钾能杀菌消毒的原因是铁元素具有强氧化性,所以杀菌、消毒;K2FeO4对应的还原产物Fe3+水解生成Fe(OH)3胶体,表面积大,具有吸附作用,所以净水。
点评:本题考察铁及其化合物之间的转化,蓝色溶液是关键点。后面的框图推断难度不大,后面的小题涉及的问题比较多,把它大题小做,落实到每一个知识点来解题。

练习册系列答案
相关题目



 7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1