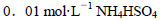题目内容
甲、乙的实验装置如图所示,丙、丁分别是氯碱工业生产示意图和制备金属钛的示意图。
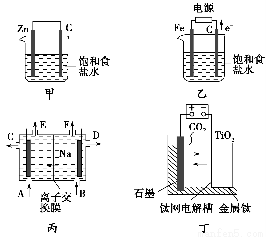
请回答下列问题:
(1)写出甲装置中碳棒表面的电极反应式:_______________________________。
(2)已知:5Cl2+I2+6H2O=10HCl+2HIO3。若将湿润的淀粉?KI试纸置于乙装置中的碳棒附近,现象为________________________________;若乙装置中转移0.02 mol电子后停止实验,烧杯中溶液的体积为200 mL,则此时溶液的pH=________。(室温条件下,且不考虑电解产物的相互反应)
(3)工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙装置中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置,Na+的移动方向如图中标注,则H2的出口是________(填“C”、“D”、“E”或“F”);________(填“能”或“不能”)将阳离子交换膜换成阴离子交换膜。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaO作电解质,利用丁装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极的电极反应式:___________________________________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)__________________________________________________________。
③电解过程中需定期更换阳极材料的原因是____________________________。
(1)O2+2H2O+4e-=4OH-
(2)试纸开始变蓝,一段时间后蓝色褪去 13
(3)E 不能
(4)①2O2--4e-=O2↑
②制备Ti时,在电解槽中发生的反应:阴极2Ca2++4e-=2Ca、阳极2O2--4e-=O2↑和2Ca+TiO2 Ti+2CaO,由此可知CaO的量不变
Ti+2CaO,由此可知CaO的量不变
③石墨与阳极产生的氧气反应而不断减少
【解析】 (1)甲装置中锌作负极,碳棒作正极,碳棒表面的电极反应式为O2+2H2O+4e-=4OH-。
(2)由乙装置中电子流向可知Fe为电解池的阴极,C为电解池的阳极,电解饱和食盐水时,碳棒上的电极反应式为2Cl--2e-=Cl2↑,若将湿润的淀粉?KI试纸置于碳棒附近,试纸开始变蓝,一段时间后蓝色褪去;惰性电极电解饱和食盐水的总反应式为2Cl-+2H2O 2OH-+Cl2↑+H2↑,则n(OH-)=n(e-)=0.02 mol,c(OH-)=0.1 mol·L-1,所以溶液的pH=13。
2OH-+Cl2↑+H2↑,则n(OH-)=n(e-)=0.02 mol,c(OH-)=0.1 mol·L-1,所以溶液的pH=13。
(3)Na+移向阴极区,阴极上产生H2,H2从E口逸出;若改用阴离子交换膜,电解产生的OH-移向阳极区,能与阳极产生的Cl2发生反应:2OH-+Cl2=Cl-+ClO-+H2O,故不能改用阴离子交换膜。
(4)根据题设条件,熔融CaO电离产生Ca2+、O2-。Ca2+在阴极获得电子生成Ca,2Ca2++4e-=2Ca,O2-在阳极失去电子产生O2,2O2--4e-=O2↑。生成的Ca与TiO2发生置换反应:2Ca+TiO2 Ti+2CaO,可见CaO的总量不变。阳极产生的O2与石墨发生反应生成CO2,所以电解过程中,应补充被消耗的阳极材料石墨。
Ti+2CaO,可见CaO的总量不变。阳极产生的O2与石墨发生反应生成CO2,所以电解过程中,应补充被消耗的阳极材料石墨。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案