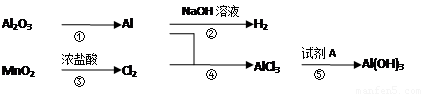题目内容
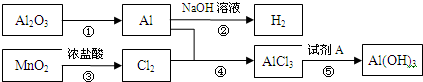
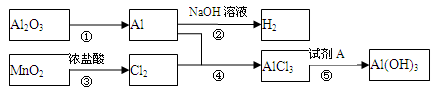
有关物质间转化关系如图,试回答:
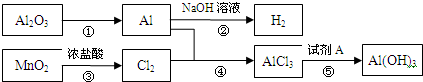
(1)转化①的反应条件为______.
(2)转化②的化学方程式为______.转化③的离子方程式为______.
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择______(填名称).
(4)向50mL 3mol?L-1 AlCl3溶液中滴加1mol?L-1 NaOH溶液,结果Al3+离子有 转化为Al(OH)3沉淀,则加入的NaOH溶液的体积可能为______mL.
转化为Al(OH)3沉淀,则加入的NaOH溶液的体积可能为______mL.
解:(1)转化①的反应条件为:融熔、电解,故答案为:融熔、电解;
(2)金属铝和强碱反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;制取氯气的离子方程式为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)由于氢氧化铝溶于强碱溶液,故制取时选用弱碱氨水,故答案是:氨水;
(4)n(AlCl3)=0.05L×3mol?L-1=0.15mol,生成的Al(OH)3沉淀为0.05mol;
第一种情况:氢氧化钠不足,只生成了氢氧化铝,n(NaOH)=3n(Al(OH)3)=0.15mol,加入的NaOH溶液的体积为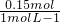 =0.15L=150mL;
=0.15L=150mL;
第二种情况:氢氧化钠部分过量,生成了0.05mol氢氧化铝,0.10mol的NaAlO2,根据反应:Al3++30H-═Al(OH)3 Al(OH)3+0H-═AlO2 -+2H2O、
Al3++40H-═AlO2 -+2H2O;
n(NaOH)=0.10mol×4+0.05mol×3=0.65mol,NaOH溶液的体积为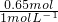 =0.65L=650nL;
=0.65L=650nL;
故答案为:150或550.
分析:(1)利用电解熔融的氧化铝可以制取金属铝;
(2)金属铝能够和强碱反应生成NaAlO2和水;二氧化锰和浓盐酸加热反应生成了氯气,离子方程式中浓盐酸写成离子形式;
(3)氢氧化铝溶于强碱溶液,不溶于弱碱,故制取氢氧化铝选用的是弱碱氨水;
(4)Al3+离子有 转化为Al(OH)3沉淀,存在两种情况,一种是氢氧化钠溶液不足,恰好生成氢氧化铝;一种是氢氧化钠稍过量,生成的沉淀有
转化为Al(OH)3沉淀,存在两种情况,一种是氢氧化钠溶液不足,恰好生成氢氧化铝;一种是氢氧化钠稍过量,生成的沉淀有  反应了,剩余
反应了,剩余 没有反应.
没有反应.
点评:本题考查铝的制取、氢氧化铝的制取、氢氧化铝的两性等知识,注意浓盐酸书写离子方程式时写成离子形式,难度中等.
(2)金属铝和强碱反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;制取氯气的离子方程式为:MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;(3)由于氢氧化铝溶于强碱溶液,故制取时选用弱碱氨水,故答案是:氨水;
(4)n(AlCl3)=0.05L×3mol?L-1=0.15mol,生成的Al(OH)3沉淀为0.05mol;
第一种情况:氢氧化钠不足,只生成了氢氧化铝,n(NaOH)=3n(Al(OH)3)=0.15mol,加入的NaOH溶液的体积为
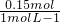 =0.15L=150mL;
=0.15L=150mL;第二种情况:氢氧化钠部分过量,生成了0.05mol氢氧化铝,0.10mol的NaAlO2,根据反应:Al3++30H-═Al(OH)3 Al(OH)3+0H-═AlO2 -+2H2O、
Al3++40H-═AlO2 -+2H2O;
n(NaOH)=0.10mol×4+0.05mol×3=0.65mol,NaOH溶液的体积为
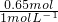 =0.65L=650nL;
=0.65L=650nL;故答案为:150或550.
分析:(1)利用电解熔融的氧化铝可以制取金属铝;
(2)金属铝能够和强碱反应生成NaAlO2和水;二氧化锰和浓盐酸加热反应生成了氯气,离子方程式中浓盐酸写成离子形式;
(3)氢氧化铝溶于强碱溶液,不溶于弱碱,故制取氢氧化铝选用的是弱碱氨水;
(4)Al3+离子有
 转化为Al(OH)3沉淀,存在两种情况,一种是氢氧化钠溶液不足,恰好生成氢氧化铝;一种是氢氧化钠稍过量,生成的沉淀有
转化为Al(OH)3沉淀,存在两种情况,一种是氢氧化钠溶液不足,恰好生成氢氧化铝;一种是氢氧化钠稍过量,生成的沉淀有  反应了,剩余
反应了,剩余 没有反应.
没有反应.点评:本题考查铝的制取、氢氧化铝的制取、氢氧化铝的两性等知识,注意浓盐酸书写离子方程式时写成离子形式,难度中等.

练习册系列答案
相关题目