题目内容
下列过程中,不涉及氧化还原反应的是
- A.浓硫酸加入蔗糖固体中
- B.金属钠放置在空气中变质
- C.SO2使品红溶液褪色
- D.NO2形成酸雨
C
A.浓硫酸加入蔗糖固体中使蔗糖碳化变黑,发生了氧化还原反应
B.金属钠放置在空气中变质最终生成了碳酸钠粉末,发生了氧化还原反应
C.SO2使品红溶液褪色体现了SO2的漂白性,是化合性漂白,没发生氧化还原反应
D.NO2形成酸雨是NO2与水反应生成硝酸和NO,化合价有变化,发生了氧化还原反应
A.浓硫酸加入蔗糖固体中使蔗糖碳化变黑,发生了氧化还原反应
B.金属钠放置在空气中变质最终生成了碳酸钠粉末,发生了氧化还原反应
C.SO2使品红溶液褪色体现了SO2的漂白性,是化合性漂白,没发生氧化还原反应
D.NO2形成酸雨是NO2与水反应生成硝酸和NO,化合价有变化,发生了氧化还原反应

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
 (2008?珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
(2008?珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
 MnO4- +
MnO4- +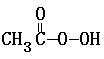 + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O +2H+ = I2+2H2O
+2H+ = I2+2H2O  的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·