题目内容
【题目】下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
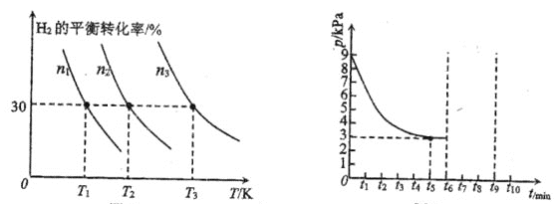
(1)有“0”刻度的是____(填字母)。
(2)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为____mL。

(3)某学生根据三次实验分别记录有关数据如表:
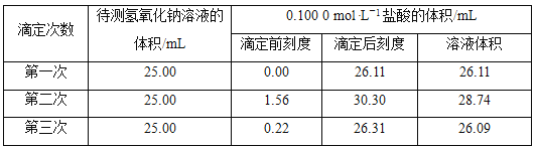
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=___。
(4)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定
【答案】cde 26.00 0.1044mol·L-1 CD
【解析】
(1)量筒、容量瓶无“0”刻度,托盘天平的“0”刻度在刻度尺的最左边。故答案为cde,26.00;
(2)滴定管可估读一位,其体积应为26.00mL;
(3)舍去第二组数据c(NaOH)= =0.1044mol·L-1。
=0.1044mol·L-1。
(4)A.中和滴定达终点时俯视滴定管内液面读数,会导致读出的酸的体积偏小,所以计算出来的碱的浓度偏低;
B.碱式滴定管没有润洗,会稀释待测碱溶液,导致浓度偏低;
C.酸式滴定管没有润洗,中和锥形瓶中的一定量的碱时,需要的酸的体积偏多,故计算出来的碱的浓度偏高;
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中会造成标准溶液被水稀释,中和锥形瓶中的一定量的碱时,需要的酸的体积偏多,故计算出来的碱的浓度偏高;
故选CD。

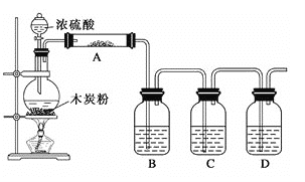
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是一种稳定的还原剂,常用作分析化学中的滴定剂。某课题组采用下列方案制备该晶体,并对其热稳定性进行了如下实验。
Ⅰ.硫酸亚铁铵晶体的制备:
铁粉![]() FeSO4溶液
FeSO4溶液![]() 结晶
结晶![]() 硫酸亚铁铵晶体
硫酸亚铁铵晶体
(1)硫酸浓度过大,反应过快同时会使FeSO4溶液中混有_____________(填离子符号)。
(2)利用FeSO4溶液与(NH4)2SO4晶体制备该晶体的化学方程式_____________。
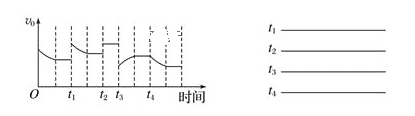
Ⅱ.硫酸亚铁铵晶体的热分解产物探究:该小组同学选用如图所示部分装置进行实验(夹持装备略)。查阅资料:隔绝空气加热至500℃硫酸亚铁铵能完全分解,产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。

(3)点燃A处的酒精灯之前,先打开弹簧夹,通一段时间N2,其目的是____________。
(4)选用上述部分必要的装置完成下列相应实验,填写横线上的内容。
检验可能产物 | 装置连接顺序 | 装置作用 | 实验现象 | 实验结论 |
H2O、NH3 | ACBGD | ①B的作用______ | ②C中________; D中__________。 | 有H2O、NH3 |
SO2、SO3 | ③___________ | ④E中HCl的作用 ___________ | E中没有明显现象,F中溶液褪色 | ⑤___________ |
(5)为证明热分解完全后残留的固体仅为Fe2O3,而不含FeO或Fe3O4,需要选用的试剂有__________(选下列字母);简述利用所选试剂进行实验证明的方案____________。
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.H2O2溶液 E.K3[Fe(CN)6]溶液