题目内容
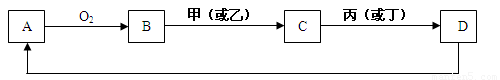
A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);![]()
试回答:
(1)写出B转化为C的可能的离子方程式______________________________。
(2)若C的溶液显酸性,用离子方程式表示其净水的原理______________________________。
(3)若C为钠盐,用含m mol C的溶液与![]() =
=![]() ,则生成D的物质的量为_______________mol。
,则生成D的物质的量为_______________mol。
(4)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式______________;若负极材料消耗
(1)Al2O3+6H+![]() 2Al3++3H2O或Al2O3+2OH-+3H2O
2Al3++3H2O或Al2O3+2OH-+3H2O![]() 2[Al(OH)4]-
2[Al(OH)4]-
(2)Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
(3)![]() (或
(或![]() )
)
(4)O2+2H2O+4e-![]() 4OH- 2NA
4OH- 2NA
解析:分析题意得出A为Al,B为Al2O3,甲(或乙)分别为H2SO4(或NaOH),
(1)Al2O3+6H+![]() 2Al3++3H2O或Al2O3+2OH-+3H2O
2Al3++3H2O或Al2O3+2OH-+3H2O![]() 2[Al(OH)4]-(或Al2O3+2OH-
2[Al(OH)4]-(或Al2O3+2OH-![]() 2
2![]() +H2O)
+H2O)
(3)C溶液呈酸性,Al3+水解,净水原理
Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
(3)n[Al(OH)4]-=m mol,n(H+)=n mol,
![]() =
=![]() 即n=
即n=![]() 。
。
[Al(OH)4]-+H+![]() Al(OH)3↓+H2O
Al(OH)3↓+H2O
m m m
Al(OH)3+3H+![]() Al3++3H2O
Al3++3H2O
![]() m m
m m
生成Al(OH)![]() m=
m=![]() m
m
或[Al(OH)4]-+H+![]() Al(OH)3↓+H2O,
Al(OH)3↓+H2O,
m n m
Al(OH)3+3H+![]() Al3++3H2O
Al3++3H2O
![]() n-m
n-m
生成Al(OH)3为m-![]() =
=![]()
或[Al(OH)4]-+H+![]() Al(OH)3↓+H2O
Al(OH)3↓+H2O
![]() n
n ![]()
Al(OH)3+3H+![]() Al3++3H2O
Al3++3H2O
![]() ×
×![]() n -
n -![]()
生成Al(OH)3为![]() -
-![]() ×
×![]() =
=![]() 。
。
(4)铂电极反应:O2+2H2O+4e-![]() 4OH-
4OH-
n(e-)=3n(Al)=3×![]() =2 mol,电子总数2NA。
=2 mol,电子总数2NA。

 名校课堂系列答案
名校课堂系列答案