题目内容
(1)2008年9月25日,“神舟七号”载人航天飞船在酒泉卫星发射中心成功发射升空。航天飞船曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
(1)写出其中涉及的化学方程式:_____________;____________。
(2)高氯酸铵作为火箭燃料的重要供氧剂。高氯酸铵在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式:____________________。
②反应中生成的氧化产物与还原产物的物质的量之比是__________,每分解1 mol高氯酸铵,转移的电子数目是__________。
(1)写出其中涉及的化学方程式:_____________;____________。
(2)高氯酸铵作为火箭燃料的重要供氧剂。高氯酸铵在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式:____________________。
②反应中生成的氧化产物与还原产物的物质的量之比是__________,每分解1 mol高氯酸铵,转移的电子数目是__________。
(1)4Al+3O2 2Al2O32NH4ClO4
2Al2O32NH4ClO4 N2↑+4H2O↑+Cl2↑+2O2↑
N2↑+4H2O↑+Cl2↑+2O2↑
(2)①4NH4ClO4 6H2O↑+2N2↑+4HCl↑+5O2↑
6H2O↑+2N2↑+4HCl↑+5O2↑
②7∶48NA或8×6.02×1023
 2Al2O32NH4ClO4
2Al2O32NH4ClO4 N2↑+4H2O↑+Cl2↑+2O2↑
N2↑+4H2O↑+Cl2↑+2O2↑(2)①4NH4ClO4
 6H2O↑+2N2↑+4HCl↑+5O2↑
6H2O↑+2N2↑+4HCl↑+5O2↑②7∶48NA或8×6.02×1023
(1)铝粉在加热被氧化时放出大量热量使高氯酸铵分解,结合题给信息产物为N2、H2O、Cl2、O2。由元素守恒可知方程式为2NH4ClO4 N2↑+4H2O↑+Cl2↑+2O2↑。
N2↑+4H2O↑+Cl2↑+2O2↑。
(2) 在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,其中N、O被氧化,Cl元素被还原。由电子守恒可知方程式为4NH4ClO4
在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,其中N、O被氧化,Cl元素被还原。由电子守恒可知方程式为4NH4ClO4 6H2O↑+2N2↑+4HCl↑+5O2↑,氧化产物N2、O2与还原产物HCl的物质的量之比=(2+5)∶4=7∶4;每分解1 mol高氯酸铵,转移的电子数目是8NA。
6H2O↑+2N2↑+4HCl↑+5O2↑,氧化产物N2、O2与还原产物HCl的物质的量之比=(2+5)∶4=7∶4;每分解1 mol高氯酸铵,转移的电子数目是8NA。
 N2↑+4H2O↑+Cl2↑+2O2↑。
N2↑+4H2O↑+Cl2↑+2O2↑。(2)
 在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,其中N、O被氧化,Cl元素被还原。由电子守恒可知方程式为4NH4ClO4
在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,其中N、O被氧化,Cl元素被还原。由电子守恒可知方程式为4NH4ClO4 6H2O↑+2N2↑+4HCl↑+5O2↑,氧化产物N2、O2与还原产物HCl的物质的量之比=(2+5)∶4=7∶4;每分解1 mol高氯酸铵,转移的电子数目是8NA。
6H2O↑+2N2↑+4HCl↑+5O2↑,氧化产物N2、O2与还原产物HCl的物质的量之比=(2+5)∶4=7∶4;每分解1 mol高氯酸铵,转移的电子数目是8NA。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 ___________+___________+___________+H2O
___________+___________+___________+H2O ___________+
___________+ >
>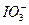 >I2
>I2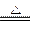 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑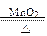 2KCl+3O2↑
2KCl+3O2↑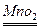 2H2O+O2↑
2H2O+O2↑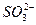 、Cl―
、Cl―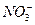
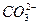
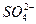 、H+
、H+