��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���д���пհ�:
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� |
(1)����ЩԪ���У���ѧ������������ǣ�___(������Ԫ�ط��Ż�ѧʽ����ͬ)����Ԫ�ص�ԭ�ӽṹʾ��ͼ��___��
(2)������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��__��������ǿ�Ļ�����Ļ�ѧʽ��___��
(3)����������������������Ԫ����_��д��������������Ӧˮ�������������Ʒ�Ӧ����ѧ����ʽ__��
(4)Ԫ�آ�����γɵ���ɫ�����������ʽ��___���û���������___(��������������������)�����
(5)�õ���ʽ��ʾ��������̬�γɵĻ�������γɹ���___������״����4.48L�û�����ͨ�������Ģۺ͢��γɵĵ���ɫ���廯�����У���ַ�Ӧ�������������___g��
���𰸡�Ar ![]() HClO4 KOH Al NaOH+Al(OH)3=NaAlO2+H2O
HClO4 KOH Al NaOH+Al(OH)3=NaAlO2+H2O ![]() ����
���� ![]() 5.6
5.6
��������
���ݸ�Ԫ����Ԫ�����ڱ��е�λ�ÿ�֪�١���ŷֱ�ΪC��N��O��Na��Al��S��Cl��Ar��K��
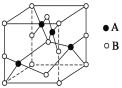
(1)��ѧ��������õ�Ԫ����ϡ������Ԫ�أ���Ar����ΪSԪ�أ���ԭ�ӽṹʾ��ͼΪ![]() ��
��
(2)�ǽ�����Խǿ������������ˮ���������Խǿ���ǽ�������ǿ�ģ�����������۵�Ԫ����ClԪ�أ���Ӧ����ΪHClO4��������Խǿ������������Ӧ��ˮ����ļ���Խǿ����������ǿ��Ԫ��ΪK�����Ӧ�ļ�ΪKOH��
(3)����������������������Ԫ����Al��������������ˮ����ΪAl(OH)3������������NaOH��Ӧ����ƫ�����ƺ�ˮ����ѧ����ʽΪNaOH+Al(OH)3=NaAlO2+H2O��
(4)OԪ�غ�NaԪ�ؿ����γɵ���ɫ������Na2O2�������ʽΪ![]() ���û����ﺬ�����Ӽ����������ӻ����
���û����ﺬ�����Ӽ����������ӻ����
(5)OԪ�ؿ�����+4�۵�CԪ���γɻ�����CO2�����γɹ��̿��Ա�ʾΪ![]() ��CO2��������Ʒ�Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2CO2=2Na2CO3+O2�����ݷ���ʽ��֪�������ƹ������ӵ������൱�ں�CO2���ʵ�����ȵ�CO�������������4.48LCO2�����ʵ���Ϊ0.2mol����������ص�����Ϊ0.2molCO��������Ϊ5.6g��
��CO2��������Ʒ�Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2CO2=2Na2CO3+O2�����ݷ���ʽ��֪�������ƹ������ӵ������൱�ں�CO2���ʵ�����ȵ�CO�������������4.48LCO2�����ʵ���Ϊ0.2mol����������ص�����Ϊ0.2molCO��������Ϊ5.6g��

 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�����Ŀ���±��Ǽ������᳣���µĵ���ƽ�ⳣ����
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=9.1��10-8 K2=1.1��10-12 | K1=7.5��10-3 K2=6.2��10-8 K3=2.2��10-13 |
������˵���в���ȷ���ǣ�������
A. ̼�������ǿ��������
B. ��Ԫ�����������Ҫ�ɵ�һ���������
C. �����£���ˮϡ�ʹ��ᣬ![]() ����
����
D. ��������Һ�м�����NaOH��Һ�����볣������