题目内容
常温下,将0.1mol的下列物质①Na2O2 ②Ba3(PO4)2 ③CH3COONa ④NaAlO2 ⑤AlCl3分别置于0.5L水中,充分搅拌后,溶液中阴离子数从大到小的排列顺序正确的是( )
分析:根据物质的溶解性,以及物质在溶液中电离出来的离子多少分析解答.
解答:解:①1molNa2O2溶于水生成2mol氢氧化钠电离出2mol氢氧根离子,所以0.1molNa2O2溶于水生成氢氧化钠电离出0.2mol氢氧根离子;
②Ba3(PO4)2难溶于水,溶液中的阴离子数目很少;
③CH3COONa溶于水,能发生水解反应,消耗1个CH3COO-,生成1个OH-和1个CH3COOH,所以阴离子数目不变,所以0.1molCH3COONa中含有0.1mol阴离子;
④偏铝酸钠溶于水,AlO2-水解,生成氢氧化铝和OH-,氢氧化铝在溶液中存在少量的电离Al(OH)3?Al3++3OH-,所以阴离子数目增大,即0.1NaAlO2中含有阴离子的量大于0.1mol;
⑤1mol氯化铝溶于水电离出3mol氯离子,所以0.1molAlCl3溶液中含有0.3mol阴离子;
所以阴离子数从大到小的排列顺序正确的是⑤①④③②,
故选C.
②Ba3(PO4)2难溶于水,溶液中的阴离子数目很少;
③CH3COONa溶于水,能发生水解反应,消耗1个CH3COO-,生成1个OH-和1个CH3COOH,所以阴离子数目不变,所以0.1molCH3COONa中含有0.1mol阴离子;
④偏铝酸钠溶于水,AlO2-水解,生成氢氧化铝和OH-,氢氧化铝在溶液中存在少量的电离Al(OH)3?Al3++3OH-,所以阴离子数目增大,即0.1NaAlO2中含有阴离子的量大于0.1mol;
⑤1mol氯化铝溶于水电离出3mol氯离子,所以0.1molAlCl3溶液中含有0.3mol阴离子;
所以阴离子数从大到小的排列顺序正确的是⑤①④③②,
故选C.
点评:本题考查了溶液中离子浓度大小比较,同时考查了盐的水解,弱电解质的电离,过氧化钠与水的反应等,题目难度中等.

练习册系列答案
相关题目
常温下,将0.1mol的金属钠、镁、铝分别投入到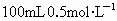 的盐酸中,完全反应后产生的氢气是
的盐酸中,完全反应后产生的氢气是
[ ]
|
A.镁、铝一样多 |
B.钠放出的多 |
|
C.镁放出的多 |
D.铝放出的多 |
常温下,将0.1mol的金属钠、镁、铝分别投入到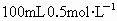 的盐酸中,完全反应后产生的氢气是
的盐酸中,完全反应后产生的氢气是
[ ]
|
A.镁、铝一样多 |
B.钠放出的多 |
|
C.镁放出的多 |
D.铝放出的多 |