题目内容
【题目】一定温度下,在三个容积均为1.0 L的恒容密闭容器中仅发生反应:CH3OH(g)+CO(g)![]() CH3COOH(g) ΔH<0。下列说法正确的是( )
CH3COOH(g) ΔH<0。下列说法正确的是( )
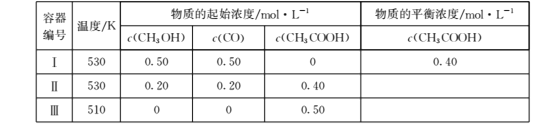
A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为3∶4
B. 达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
D. 达平衡时,容器Ⅰ中CH3OH转化率与容器Ⅲ中CH3COOH转化率之和小于1
【答案】BD
【解析】A. 容器Ⅰ与容器Ⅱ中的总压强之比等于混合气体的物质的量之比,起始时压强之比![]() =
=![]() =
=![]() ,随着反应的进行,容器Ⅰ与容器Ⅱ中的混合气体的物质的量发生变化,因此达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比不再等于3∶4,A错误;B.容器Ⅰ中起始浓度为:CH3OH为0.5 mol·L-1、CO为0.5 mol·L-1,容器Ⅱ中将CH3COOH转化为反应物,则起始浓度为:CH3OH为0.6 mol·L-1、CO为0.6 mol·L-1,容器中Ⅰ和容器Ⅱ的温度相同,体积相同且固定不变,对于反应CH3OH(g)+CO(g)
,随着反应的进行,容器Ⅰ与容器Ⅱ中的混合气体的物质的量发生变化,因此达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比不再等于3∶4,A错误;B.容器Ⅰ中起始浓度为:CH3OH为0.5 mol·L-1、CO为0.5 mol·L-1,容器Ⅱ中将CH3COOH转化为反应物,则起始浓度为:CH3OH为0.6 mol·L-1、CO为0.6 mol·L-1,容器中Ⅰ和容器Ⅱ的温度相同,体积相同且固定不变,对于反应CH3OH(g)+CO(g)![]() CH3COOH(g),压强越大时平衡越有利于向正反应方向移动,因此容器Ⅱ中
CH3COOH(g),压强越大时平衡越有利于向正反应方向移动,因此容器Ⅱ中![]() 比容器Ⅰ中的大,B正确;C. 容器Ⅲ中将CH3COOH转化为反应物,则容器Ⅲ中起始浓度为:CH3OH为0.5 mol·L-1、CO为0.5 mol·L-1,而容器Ⅰ中起始浓度为:CH3OH为0.5 mol·L-1、CO为0.5,容器Ⅲ和容器Ⅰ中起始浓度相同,但是容器Ⅰ中的温度高于容器Ⅲ,因此达平衡时,容器Ⅰ中的正反应速率比容器Ⅲ中的大,C错误;D. 容器Ⅲ中将CH3COOH转化为反应物,则容器Ⅰ和容器Ⅲ中反应物的起始浓度相同,若容器Ⅰ和容器Ⅲ中温度相同,达平衡时CH3OH转化率与CH3COOH转化率之和等于1,但容器Ⅰ中温度高,且正反应方向是放热的,导致容器Ⅰ中CH3OH转化率降低,所以容器Ⅰ中CH3OH转化率与容器Ⅲ中CH3COOH转化率之和小于1,D正确;答案选BD.
比容器Ⅰ中的大,B正确;C. 容器Ⅲ中将CH3COOH转化为反应物,则容器Ⅲ中起始浓度为:CH3OH为0.5 mol·L-1、CO为0.5 mol·L-1,而容器Ⅰ中起始浓度为:CH3OH为0.5 mol·L-1、CO为0.5,容器Ⅲ和容器Ⅰ中起始浓度相同,但是容器Ⅰ中的温度高于容器Ⅲ,因此达平衡时,容器Ⅰ中的正反应速率比容器Ⅲ中的大,C错误;D. 容器Ⅲ中将CH3COOH转化为反应物,则容器Ⅰ和容器Ⅲ中反应物的起始浓度相同,若容器Ⅰ和容器Ⅲ中温度相同,达平衡时CH3OH转化率与CH3COOH转化率之和等于1,但容器Ⅰ中温度高,且正反应方向是放热的,导致容器Ⅰ中CH3OH转化率降低,所以容器Ⅰ中CH3OH转化率与容器Ⅲ中CH3COOH转化率之和小于1,D正确;答案选BD.
