题目内容
【题目】铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学,为测定某铝镁合金(不含其他元素)中镁的质量分数,设计下列不同实验方案进行探究。填写下列空白。

探究一
实验方案:铝镁合金加入某溶液,测定剩余固体质量(实验装置如图所示)。用单线桥表示出所发生反应的电子转移情况
(1)_________________________________________________。
(2)实验前,先将镁铝合金在稀酸中浸泡片刻,其目的是_____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是___(填序号);记录C的液面位置时,除视线平视外,还应________________。
(4)称取铝镁合金粉末样品m g于B中,向A中加入上述某溶液,反应后测得生成气体体积标况下为VmL,则镁的质量分数为________________。
探究二
实验方案:铝镁合金![]() 测定生成气体的体积(实验装置如图所示),问题讨论:
测定生成气体的体积(实验装置如图所示),问题讨论:

(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是________(填“需要”或“不需要”)。为什么?_________________________
(2)现取镁铝合金粉末0.78g,完全反应后生成的气体的体积在标况下为896mL,则合金粉末中铝的物质的量为________,镁的质量分数为___________。
【答案】 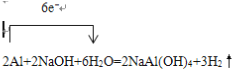 除去铝镁合金表面的氧化膜 ⑤①④③② 使D和C的液面相平,溶液冷却至室温
除去铝镁合金表面的氧化膜 ⑤①④③② 使D和C的液面相平,溶液冷却至室温 ![]() 不需要 酸雾易溶于水 0.02mol 30.8%
不需要 酸雾易溶于水 0.02mol 30.8%
【解析】探究一(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,单线桥表示出所发生反应的电子转移情况,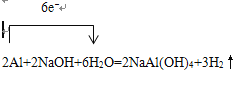 ;(2)实验前,先将镁铝合金在稀酸中浸泡片刻,其目的是除去铝镁合金表面的氧化膜;(3)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,操作的顺序是⑤①④③②(填序号);记录C的液面位置时,除视线平视外,还应使D和C的液面相平,溶液冷却至室温。(4)由方程式
;(2)实验前,先将镁铝合金在稀酸中浸泡片刻,其目的是除去铝镁合金表面的氧化膜;(3)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,操作的顺序是⑤①④③②(填序号);记录C的液面位置时,除视线平视外,还应使D和C的液面相平,溶液冷却至室温。(4)由方程式
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 67.2L
x VL
x=54g×VL/67.2L=54V/67.2g,镁的质量分数=![]() ×100%=
×100%=![]() ;
;
探究二:(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;(2)由题意:令Al和Mg的物质的量分别是x、y,则有27x+24y=0.78,又由电子守恒3x+2y=2×0.896L/22.4L·mol-1,解得x=0.02mol,y=0.01mol,镁的质量分数为![]() ×100%=30.8%。
×100%=30.8%。




