题目内容
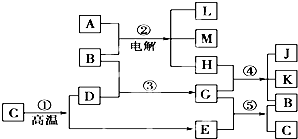
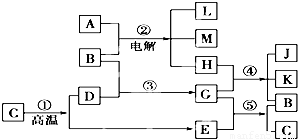
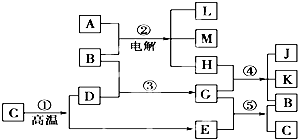 根据如图反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
(1)单质L是______.化合物A是______.
(2)图中除反应①以外,还有两个用于工业生产的反应,是______ 和______(填代号).
它们反应的化学方程式分别是______;______.
(3)E和K、J混合溶液反应的化学方程式为______.此反应的发生说明酸的强弱关系为______.
解:反应①是工业上生产化合物D的反应,常见的是高温分解石灰石的反应,C为CaCO3,D为CaO,E为CO2.再由⑤是实验室鉴定E的反应,可知G为Ca(OH)2,B为H2O.则反应②是电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,
2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,
(1)由以上分析可知L为H2,A为NaCl,故答案为:H2;NaCl;
(2)反应②是电解饱和食盐水,方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,④为制漂白粉的反应,
2NaOH+H2↑+Cl2↑,④为制漂白粉的反应,
方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,
故答案为:②;④;2NaCl+2H2O 2NaOH+H2↑+Cl2↑;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
2NaOH+H2↑+Cl2↑;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
(3)E和K、J混合溶液反应的化学方程式为2Ca(OH)2+CO2=CaCO3+2HClO,符合强酸制取弱酸的原理,酸性H2CO3>HClO,
故答案为:2Ca(OH)2+CO2=CaCO3+2HClO;H2CO3>HClO.
分析:由题意可知,反应①是工业上生产化合物D的反应,常见的是高温分解石灰石的反应,C为CaCO3,D为CaO,E为CO2.再由⑤是实验室鉴定E的反应,可知G为Ca(OH)2,B为H2O.则反应②是电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,
2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,
方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,结合物质的相关性质以及题目要求可解答该题.
点评:本题综合考查元素化合物知识,难度较大,要注意充分利用反应条件等信息,打开“突破口”,特别要注意常见工业生产.
 2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,
2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,(1)由以上分析可知L为H2,A为NaCl,故答案为:H2;NaCl;
(2)反应②是电解饱和食盐水,方程式为2NaCl+2H2O
 2NaOH+H2↑+Cl2↑,④为制漂白粉的反应,
2NaOH+H2↑+Cl2↑,④为制漂白粉的反应,方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,
故答案为:②;④;2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
2NaOH+H2↑+Cl2↑;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;(3)E和K、J混合溶液反应的化学方程式为2Ca(OH)2+CO2=CaCO3+2HClO,符合强酸制取弱酸的原理,酸性H2CO3>HClO,
故答案为:2Ca(OH)2+CO2=CaCO3+2HClO;H2CO3>HClO.
分析:由题意可知,反应①是工业上生产化合物D的反应,常见的是高温分解石灰石的反应,C为CaCO3,D为CaO,E为CO2.再由⑤是实验室鉴定E的反应,可知G为Ca(OH)2,B为H2O.则反应②是电解饱和食盐水:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,
2NaOH+H2↑+Cl2↑,则A为NaCl,产物中只有Cl2能够与Ca(OH)2反应,故H为Cl2,则单质L为H2,④为制漂白粉的反应,方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,结合物质的相关性质以及题目要求可解答该题.
点评:本题综合考查元素化合物知识,难度较大,要注意充分利用反应条件等信息,打开“突破口”,特别要注意常见工业生产.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 根据如图反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.