题目内容
(10分)随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol?L-1时通常认为该离子沉淀完全)。
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol?L-1。为除去其中的Fe3+,回收铜,需控制的pH范围是_______________________________。
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
①Cr2O72-转变为Cr3+的离子方程式为______________________。
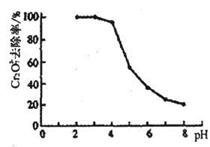
②pH对废水中Cr2O72-去除率的影响如图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:_________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,式中:co—处理前废水中Cr2O72-浓度,c—处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用。例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaSO4)=9.1x10-6,Ksp (CaCO3)=2.8×10-9]
| 金属离子 | Ksp | pH(10-1 mol?L-1) | pH(10-5 mol?L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
| Ca2+ | 4.0×10-5 | 12.3 | 14.3 |
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
①Cr2O72-转变为Cr3+的离子方程式为______________________。
②pH对废水中Cr2O72-去除率的影响如图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:_________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,式中:co—处理前废水中Cr2O72-浓度,c—处理后废水中Cr2O72-的浓度]

(3)沉淀转化在生产中也有重要应用。例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaSO4)=9.1x10-6,Ksp (CaCO3)=2.8×10-9]
(1)3.7≤pH<4.7(2分)
(2)①Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O(2分)
②4.3~5.6(或5~6)(2分) pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小(2分)
(3)3.25×103(2分)
(2)①Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O(2分)
②4.3~5.6(或5~6)(2分) pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小(2分)
(3)3.25×103(2分)
(1)由所给数据可看出,Fe3+在pH=3.7时已完全沉淀,而Cu2+在pH=4.7时才开始沉淀,所以为除去其中的Fe3+,回收铜,需控制的pH范围是3.7≤pH<4.7
(2)①废水以Fe为电极进行电解,铁作阳极铁电子生成Fe2+:Fe —2e—=Fe2+,Fe2+还原Cr2O72-:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
②综合考虑所给信息,虽然pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离(Cr3+在pH=4.3时才开始沉淀,在pH=5.6时完全沉淀),pH太高,Cr2O72-的去除率太小,无实际意义,综合分析可知pH取值在4.3~5.6(或5~6)范围内对降低废水中的铬含量最有利
(3)由转化方程式得:K=Ksp (CaSO4)=9.1x10-6 / Ksp (CaCO3)= 3.25×103
(2)①废水以Fe为电极进行电解,铁作阳极铁电子生成Fe2+:Fe —2e—=Fe2+,Fe2+还原Cr2O72-:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
②综合考虑所给信息,虽然pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离(Cr3+在pH=4.3时才开始沉淀,在pH=5.6时完全沉淀),pH太高,Cr2O72-的去除率太小,无实际意义,综合分析可知pH取值在4.3~5.6(或5~6)范围内对降低废水中的铬含量最有利
(3)由转化方程式得:K=Ksp (CaSO4)=9.1x10-6 / Ksp (CaCO3)= 3.25×103

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)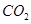 后仍能大量共存的一组是
后仍能大量共存的一组是