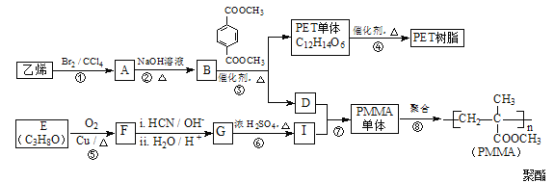
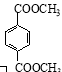
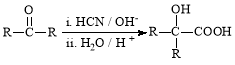题目内容
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如下图所示装置进行有关实验。

(1)装置A中发生反应的化学方程式为____________________________。
(2)装置D中试管口放置的棉花应浸一种溶液,这种溶液是________,其作用是________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_______________,
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是______________________。
【答案】(1)Cu+2H2SO4(浓) =CuSO4+SO2↑+H2O (2)NaOH;吸收多余的SO2;
(3)瓶中液面下降,漏斗液面上升(4)随着反应进行浓H2SO4变为稀H2SO4
【解析】
试题分析:(1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓) =CuSO4+SO2↑+H2O,故答案为:Cu+2H2SO4(浓) =CuSO4+SO2↑+H2O;
(2)装置D中试管口放置的棉花浸上氢氧化钠溶液,可以吸收多余的SO2,防止二氧化硫污染空气,故答案为:NaOH;吸收多余的SO2;
(3)当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象为瓶中液面下降,漏斗液面上升,故答案为:瓶中液面下降,漏斗液面上升;
(4)随着反应进行浓H2SO4变为稀H2SO4,稀硫酸与铜不反应,故答案为:随着反应进行浓H2SO4变为稀H2SO4。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目