题目内容
下列涉及离子方程式书写的评价合理的是 ( )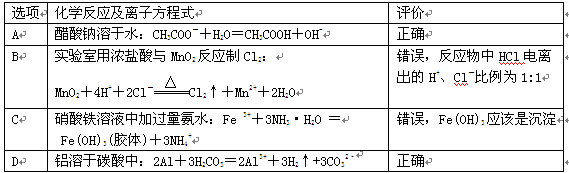
C
解析试题分析:A项:水解反应是可逆反应,符号应为“ ”;B项:离子方程式是正确的,多余的2个Cl-在溶液中没参加化学反应;D项:铝与碳酸会有所反应,反映分为两步。碳酸是CO2的水溶液,里面有H+、OH-、CO32-、HCO3-、H2O、H2CO3、CO2这几种离子和物质,当AL投入的时候,会与水发生反应,产生Al(OH)3,如果只是纯粹水溶液的话由于反映产生的Al(OH)3是一层质密的薄膜,将Al与水阻挡开,使反应停止。但是水溶液里面还有大量酸性的H+、HCO3-离子,会与Al(OH)3反映,使反应继续下去,最终反应能够得到Al3+离子的,其实反映的实质就是Al+6H2O —— 2Al(OH)3+3H2,而中间借助了酸溶液的酸性,使反应不断进行,最后得到Al3+,但是水解又会得到Al(OH)3,Al3++3H2O=Al(OH)3+3H+,而酸是弱酸,双水解情况下,不存在Al2(CO3)3,所以最后就是得到Al(OH)3,而不是单质Al,,反映的现象是冒气泡和生成沉淀,总之:碳酸铝是不存在的,或者说是极其不稳定,只有在少数高端实验室条件下才可以实现。而单质铝投入碳酸水中是会反应的,实验现象是生成沉淀和冒气泡,沉淀是氢氧化铝。故选C。
”;B项:离子方程式是正确的,多余的2个Cl-在溶液中没参加化学反应;D项:铝与碳酸会有所反应,反映分为两步。碳酸是CO2的水溶液,里面有H+、OH-、CO32-、HCO3-、H2O、H2CO3、CO2这几种离子和物质,当AL投入的时候,会与水发生反应,产生Al(OH)3,如果只是纯粹水溶液的话由于反映产生的Al(OH)3是一层质密的薄膜,将Al与水阻挡开,使反应停止。但是水溶液里面还有大量酸性的H+、HCO3-离子,会与Al(OH)3反映,使反应继续下去,最终反应能够得到Al3+离子的,其实反映的实质就是Al+6H2O —— 2Al(OH)3+3H2,而中间借助了酸溶液的酸性,使反应不断进行,最后得到Al3+,但是水解又会得到Al(OH)3,Al3++3H2O=Al(OH)3+3H+,而酸是弱酸,双水解情况下,不存在Al2(CO3)3,所以最后就是得到Al(OH)3,而不是单质Al,,反映的现象是冒气泡和生成沉淀,总之:碳酸铝是不存在的,或者说是极其不稳定,只有在少数高端实验室条件下才可以实现。而单质铝投入碳酸水中是会反应的,实验现象是生成沉淀和冒气泡,沉淀是氢氧化铝。故选C。
考点:离子方程式正误判断
点评:离子方程式正误判断要注意:看原则:看是否符合客观事实、看是否符合质量守恒、看是否符合电荷守恒、看是否符合得失电子相等、看连接符号是否正确、注意双水解的离子不能共存。可溶的易电离的物质拆成离子。注意过量、少量、适量等。

 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案下列涉及离子方程式书写的评价合理的是
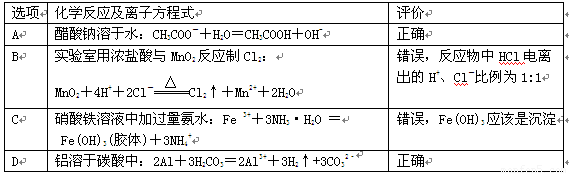
| 选项 | 化学反应及离子方程式 | 评 价 |
| A | 醋酸钠溶于水:CH3COO-+H2O=CH3COOH+OH- | 正确 |
| B | 实验室用浓盐酸与MnO2反应制Cl2: | 错误,反应物中HCl电离出的H+、Cl-比例为1:1 |
| C | 硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O= Fe(OH)3(胶体)+3NH4+ | 错误,Fe(OH)3应该是沉淀 |
| D | NH4HCO3溶液与过量的NaOH溶液反应: HCO3-+OH-=CO32-+H2O | 正确 |
下列涉及离子方程式书写的评价合理的是
|
选项 |
化学反应及离子方程式 |
评 价 |
|
A |
醋酸钠溶于水:CH3COO-+H2O=CH3COOH+OH- |
正确 |
|
B |
实验室用浓盐酸与MnO2反应制Cl2:
|
错误,反应物中HCl电离出的H+、Cl-比例为1:1 |
|
C |
硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O= Fe(OH)3(胶体)+3NH4+ |
错误,Fe(OH)3应该是沉淀 |
|
D |
NH4HCO3溶液与过量的NaOH溶液反应: HCO3-+OH-=CO32-+H2O |
正确 |
下列涉及离子方程式书写的评价合理的是
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 醋酸钠溶于水:CH3COO-+H2O=CH3COOH+OH- | 正确 |
| B | 实验室用浓盐酸与MnO2反应制Cl2: | 错误,反应物中HCl电离出的H+、Cl-比例为1:1 |
| C | 硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O= Fe(OH)3(胶体)+3NH4+ | 错误,Fe(OH)3应该是沉淀 |
| D | NH4HCO3溶液与过量的NaOH溶液反应: HCO3-+OH-=CO32-+H2O | 正确 |