题目内容
向2 L的密闭容器中充入7.6 mol NO和3.8 mol O2,发生如下反应:
①2NO(g)+O2(g)=2NO2(g) ②2NO2(g) N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10 min维持容器温度为T1℃,10 min后升高并维持容器的温度为T2℃。
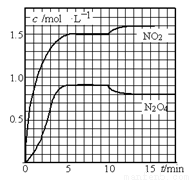
(1)计算前5 min N2O4反应的平均速率。
(2)计算T1℃时反应②的化学平衡常数。
(3)若起始时向该容器中充入3.6 mol NO2和2.0 mol N2O4,判断T1℃时反应②进行的方向,并计算达到平衡时N2O4的物质的量。
练习册系列答案
相关题目
一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH,已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g) ΔH,已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1100 |
平衡常数 | 0.68 | 0.50 |
请回答下列问题:
(1)该反应的ΔH 0
(2)T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为α1,c(CO2)=0.15mol•L-1,则温度T (填高于、低于、等于)1000,若此时保持其它条件不变再充入2.0 mol CO(g),再达平衡时测得CO转化α2,则α1 α2(填>、<或=)。


 C2H4(g)①
C2H4(g)① H2(g)=
H2(g)=