题目内容
设N 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
A.4.6 g组成为 的有机物,所含C—H键数目一定为0.6N
的有机物,所含C—H键数目一定为0.6N
B.8.7 g  与40 mL 10
与40 mL 10  的浓盐酸充分反应,生成的氯气分子数为0.1N
的浓盐酸充分反应,生成的氯气分子数为0.1N
C. 1 mol  中含有的阴、阳离子总数是3N
中含有的阴、阳离子总数是3N 而1 mol
而1 mol  中含有的阴、阳离子总数是4N
中含有的阴、阳离子总数是4N
D.在反应

 ↑
↑ 中,每生成4 mol
中,每生成4 mol  转移电子数为15N
转移电子数为15N
【答案】
D
【解析】A不正确,因为该化合物可能是是甲醚,也可能是乙醇;二氧化锰和浓盐酸在反应过程中,盐酸的浓度逐渐降低,而二氧化锰不能氧化稀盐酸,所以选项B中生成的氯气分子数小于0.1N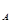 ,B不正确;C不正确,过氧化钠中阳离子和阴离子的个数之比也是2︰1的,即含有的阴、阳离子总数是3N
,B不正确;C不正确,过氧化钠中阳离子和阴离子的个数之比也是2︰1的,即含有的阴、阳离子总数是3N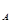 ;选项D中其氧化剂的NO3-是2mol,其还原剂的NH4+是5mol,所以转移电子是15mol,D正确,答案选D。
;选项D中其氧化剂的NO3-是2mol,其还原剂的NH4+是5mol,所以转移电子是15mol,D正确,答案选D。

练习册系列答案
相关题目
|
设N为阿伏加德罗常数的值,常温条件下,下列说法正确的是 | |
| [ ] | |
A. |
pH=13的NaOH溶液中OH-离子数目为0.1 N |
B. |
1 L 0.1 mol·L-1的氨水中OH-离子数目为0.1 N |
C. |
I L pH=1的H2SO4溶液中H+离子数目为0.1 N |
D. |
1 L 0.1 mol·L-1的NH4NO3溶液中NH4+离子数目为0.1 N |
设N 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
A.4.6 g组成为 的有机物,所含C—H键数目一定为0.6N 的有机物,所含C—H键数目一定为0.6N |
B.8.7 g  与40 mL 10 与40 mL 10  的浓盐酸充分反应,生成的氯气分子数为0.1N 的浓盐酸充分反应,生成的氯气分子数为0.1N |
C.1 mol  中含有的阴、阳离子总数是3N 中含有的阴、阳离子总数是3N 而1 mol 而1 mol 中含有的阴、阳离子总数是4N 中含有的阴、阳离子总数是4N |
D.在反应   ↑ ↑ 中,每生成4 mol 中,每生成4 mol  转移电子数为15N 转移电子数为15N |