题目内容
16.下列说法不正确的是( )| A. | ${\;}_{\;}^{12}$C和${\;}_{\;}^{14}$C互为同位素 | |
| B. | 乙醇与二甲醚(CH3-O-CH3)互为同分异构体 | |
| C. | 红磷与白磷互为同素异形体 | |
| D. | H2O与D2O互为同位素 |
分析 A.质子数相同,中子数不同的原子互称同位素;
B.具有相同分子式而结构不同的化合物互为同分异构体;
C.同种元素形成的不同单质互为同素异形体;
D.同位素必须是原子,H2O与D2O为化合物.
解答 解:A. 质子数相同为2,中子数分别为1、2不同,故互为同位素,故A正确;
B.乙醇(C2H5OH)与二甲醚(CH3-O-CH3)分子式相同都为C2H6O,但结构不同,故互为同分异构体,故B正确;
C.红磷与白磷都是由磷元素形成的不同单质,故互为同素异形体,故C正确;
D.H2O与D2O为氢氧元素组成的化合物,同位素必须是原子,故D错误;
故选D.
点评 本题考查同位素、同分异构体、同素异形体判别,题目难度不大,侧重考查学生的辨别能力,选项多,要细心排查,明确同位素、同分异构体、同素异形体等概念是解答本题的关键.

练习册系列答案
相关题目
7.在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
| A. | 若滤出的固体只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+ | |
| B. | 若滤出的固体只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+ | |
| C. | 若滤出的固体只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+ | |
| D. | 若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+ |
4.关于O3的说法中错误的是( )
①O3具有刺激性臭味,因此被称为“臭氧”
②O2与O3是氧元素的同素异形体
③O3比O2密度大,也比O2易溶于水
④O3比O2稳定,高温下不易分解
⑤臭氧有漂白和消毒作用
⑥空气中微量O3可以刺激中枢神经,加快血液循环,因此空气中O3含量越高越好
⑦空气中高压放电、高压电机和复印机工作都会有O3生成.
①O3具有刺激性臭味,因此被称为“臭氧”
②O2与O3是氧元素的同素异形体
③O3比O2密度大,也比O2易溶于水
④O3比O2稳定,高温下不易分解
⑤臭氧有漂白和消毒作用
⑥空气中微量O3可以刺激中枢神经,加快血液循环,因此空气中O3含量越高越好
⑦空气中高压放电、高压电机和复印机工作都会有O3生成.
| A. | ①②③ | B. | ④⑤⑥ | C. | ④⑥ | D. | ⑤⑦ |
11.参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( ) 

| A. | 正反应为放热反应 | |
| B. | 加入催化剂,该化学反应的反应热不变 | |
| C. | 反应物总能量高于生成物总能量 | |
| D. | 升高温度可增大正反应速率,降低逆反应速率 |
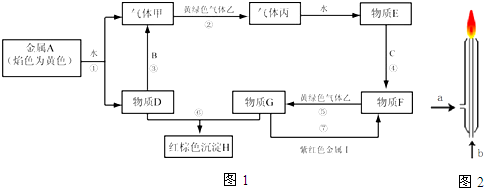
3.氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1实验装置.请回答:
(1)按图连接好实验装置,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好
(2)写出以下仪器的名称:A(恒压)分液漏斗 B干燥管
(3)实验中制取氮化铝(碳过量)的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
(4)化学研究小组的此装置存在严重缺陷,请说明改进的方法在干燥管D末端连一尾气处理装置
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气.
①量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水
c.煤油 d.饱和氯化铵溶液
②本实验应对量气管多次读数,读数时应注意:a.视线与凹液面最低处相平b.恢复至室温c.使量气管与干燥管两端液面相平
③实验获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
根据上述数据,可计算出样品中AlN的质量分数为61.5%.

(1)按图连接好实验装置,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好
(2)写出以下仪器的名称:A(恒压)分液漏斗 B干燥管
(3)实验中制取氮化铝(碳过量)的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
(4)化学研究小组的此装置存在严重缺陷,请说明改进的方法在干燥管D末端连一尾气处理装置
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气.
①量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水
c.煤油 d.饱和氯化铵溶液
②本实验应对量气管多次读数,读数时应注意:a.视线与凹液面最低处相平b.恢复至室温c.使量气管与干燥管两端液面相平
③实验获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
| 编号 | 氮化铝样品质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 350.0mL | 13.7mL |
| ② | 1.0g | 350.0mL | 25.0mL |
| ③ | 1.0g | 350.0mL | 14.3mL |
10.蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名.蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成.工业上由蛇纹石制取碱式碳酸镁产品的流程如下:
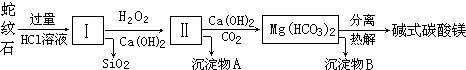
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是Fe3+、Fe2+.
(2)向Ⅰ中加入H2O2的作用是将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3,有关离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O,加入Ca(OH)2时,需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表).
若pH>8可能导致的后果Al(OH)3溶解、Mg2+沉淀.
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入NaOH溶液,然后过滤、洗涤、(干燥)灼烧(填写实验操作名称),即可获得红色颜料,实现废物的综合利用.
(4)若产品的化学式用aMgCO3•bMg(OH)2•cH2O表示,现称取18.2g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0g MgO,通过计算确定产品的化学式中:a=3,b=1,c=3.

(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是Fe3+、Fe2+.
(2)向Ⅰ中加入H2O2的作用是将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3,有关离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O,加入Ca(OH)2时,需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表).
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入NaOH溶液,然后过滤、洗涤、(干燥)灼烧(填写实验操作名称),即可获得红色颜料,实现废物的综合利用.
(4)若产品的化学式用aMgCO3•bMg(OH)2•cH2O表示,现称取18.2g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0g MgO,通过计算确定产品的化学式中:a=3,b=1,c=3.
7.铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4,3mol FeS2参加反应转移32mol 电子.
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,从腐蚀废液回收得到金属铜还需要的试剂为铁粉、稀硫酸.
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4,3mol FeS2参加反应转移32mol 电子.
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,从腐蚀废液回收得到金属铜还需要的试剂为铁粉、稀硫酸.
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可以用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 铁在空气中表面生成致密氧化膜 | 可用铁罐储存运输浓硫酸、浓硝酸 | Ⅰ对;Ⅱ对;有 |