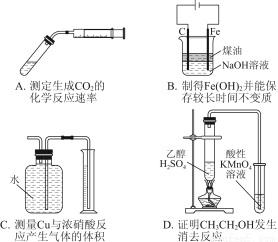
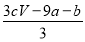题目内容
下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样 白色沉淀
白色沉淀 沉淀不溶解―→说明试样已变质
沉淀不溶解―→说明试样已变质
B.除去粗盐中含有的硫酸钙杂质粗盐

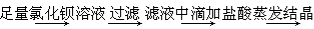 精盐
精盐
C.检验某溶液中是否含有Fe2+试样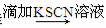 溶液颜色无变化
溶液颜色无变化 溶液变红色―→溶液中含有Fe2+
溶液变红色―→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液 溶液变蓝色―→氧化性:H2O2>I2
溶液变蓝色―→氧化性:H2O2>I2
C
【解析】A项中加入硝酸钡溶液引入的NO3-和加入盐酸引入的H+能将SO32-氧化,错误;B项中引入了杂质氯化钡,错误;D项中硝酸具有强氧化性,也能将I-氧化为I2,应用盐酸或稀硫酸酸化,错误。

练习册系列答案
相关题目