题目内容
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )
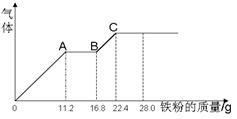
A.混合液中NO3-的物质的量为0.2 mol
B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5 mol·L-1
D
解析:
由AB段气体数量不变知,此阶段是Fe3+与单质铁之间的反应,BC阶段发生的是H+与单质铁的反应,B对;OA段消耗0.2mol铁且此阶段反应结束时,溶液中还剩余有H+,说明此时溶液中NO3-全部反应完了,故由4H++NO3-+Fe=2H2O+NO↑+Fe3+,求得n(NO3-)=0.2mol,A对。

练习册系列答案
相关题目