题目内容
(16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。 Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)  2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。
2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。 (2)在一定温度和压强下,已知:
(2)在一定温度和压强下,已知:
O2 (g) = O2+ (g) + e-; H1=" 1175.7" kJ/mol
H1=" 1175.7" kJ/mol PtF6 (g) + e- = PtF6- (g);
PtF6 (g) + e- = PtF6- (g); H2=" ―771.1" kJ/mol
H2=" ―771.1" kJ/mol O2PtF6 (s) = O2+ (g) + PtF6- (g);
O2PtF6 (s) = O2+ (g) + PtF6- (g);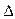 H3=" 482.2" kJ/mol
H3=" 482.2" kJ/mol 则反应O2 (g) + PtF6 (g) = O2PtF6(s);
则反应O2 (g) + PtF6 (g) = O2PtF6(s); H="_____________" kJ/mol。
H="_____________" kJ/mol。 Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是 。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”)。
(16分)Ⅰ.(1)向左(2分) 不改变 (2分) (2)-77.6 (2分)
Ⅱ.(1)⑤(2分) (2)②③④(2分) (3)>(2分) (4)>(2分) >(2分)
解析

 H3=482.2 kJ/mol
H3=482.2 kJ/mol CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
 CH3OH(g) ΔH>-91 kJ·mol-1
CH3OH(g) ΔH>-91 kJ·mol-1
 。
。
 2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡
(填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH
(填“增大”、“减小”或“不改变”)。
2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡
(填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH
(填“增大”、“减小”或“不改变”)。 (2)在一定温度和压强下,已知:
(2)在一定温度和压强下,已知: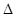 H1= 1175.7 kJ/mol
H1= 1175.7 kJ/mol O2PtF6 (s)
= O2+ (g) + PtF6- (g);
O2PtF6 (s)
= O2+ (g) + PtF6- (g); H3=
482.2 kJ/mol
H3=
482.2 kJ/mol