题目内容
【题目】如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL 盐酸于试管中,试回答下列问题:
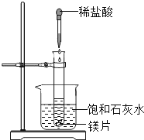
(1)写出试管内反应的离子方程式_____________________;
(2)写出生成物MgCl2的电子式__________________;
(3)实验中观察到石灰水中的现象__________,产生上述现象的原因是___________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
【答案】Mg+2H+=Mg2++H2↑ ![]() 烧杯中析出晶体 镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 小于
烧杯中析出晶体 镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 小于
【解析】
镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,反应物总能量高于生成物总能量的反应为放热反应,据此解答。
(1)镁与盐酸反应生成氯化镁和氢气,反应的离子方程式是:Mg+2H+=Mg2++H2↑;(2)MgCl2是离子化合物,Cl-与Mg2+之间通过离子键结合,用电子式表示为:![]() ;
;
(3)镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,所以饱和石灰水中会有氢氧化钙沉淀析出,烧杯中析出晶体;
(4)镁与盐酸反应生成氯化镁和氢气的反应是放热反应,说明反应物的Mg、HCl的总能量高于生成物MgCl2和H2的总能量。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目