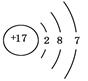
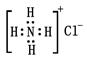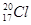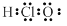题目内容
(6分)已知①氯水和溴水能将Fe2+氧化成Fe3+,而碘水不能;②Fe3+可以使KI—淀粉试液变蓝色。
(1)向100mlFeBr2溶液中通入标况下体积为3.36L的Cl2,充分反应后测得溶液中Cl—和Br—的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为 ;
(2)向含1molFeI2和2molFeBr2的溶液中通入3molCl2后,溶液中所含各种离子的个数之比是 ;
(3)向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,若要保证溶液中含有两种阳离子,
c的取值范围是 。
(1)向100mlFeBr2溶液中通入标况下体积为3.36L的Cl2,充分反应后测得溶液中Cl—和Br—的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为 ;
(2)向含1molFeI2和2molFeBr2的溶液中通入3molCl2后,溶液中所含各种离子的个数之比是 ;
(3)向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,若要保证溶液中含有两种阳离子,
c的取值范围是 。
(1)2mol/L(2分);
(2)Fe3+:Cl—:Br—=1:2:1(2分);
(3)a<c<(1.5a+0.5b) (2分)。
(2)Fe3+:Cl—:Br—=1:2:1(2分);
(3)a<c<(1.5a+0.5b) (2分)。
离子的还原性Fe2+是大于Br-的。所以被氧化的顺序是先Fe2+后Br-。
标况下氯气3.36L,即有0.15mol氯气,氯气全部被还原,所以转移的电子数是0.3mol。
设有FeBr2物质的量为x mol,被氧化了的Br-为y(Fe2+要1个电子,Br-也要1个)
x+y=0.3
又因为c(Br-)=c(Cl-),明显这些是剩下的Br-,所以
2x-y=0.3
解得X="0.2" mol
因为体积是100ml,所以浓度c(FeBr2)=2mol/
还有,平时要注意离子的还原性强弱顺序,如过是FeI,则是先氧化碘。I- > Fe2+ > Br-
标况下氯气3.36L,即有0.15mol氯气,氯气全部被还原,所以转移的电子数是0.3mol。
设有FeBr2物质的量为x mol,被氧化了的Br-为y(Fe2+要1个电子,Br-也要1个)
x+y=0.3
又因为c(Br-)=c(Cl-),明显这些是剩下的Br-,所以
2x-y=0.3
解得X="0.2" mol
因为体积是100ml,所以浓度c(FeBr2)=2mol/
还有,平时要注意离子的还原性强弱顺序,如过是FeI,则是先氧化碘。I- > Fe2+ > Br-

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。