题目内容
(1).将质量比为14:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为______,该混合气体的平均摩尔质量为______.
(2)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2所占的体积由大到小的顺序是(填序号,下同)______;密度由大到小的顺序是______.
(3)VmL Al2(SO4)3溶液中含Al3+ag,取V/4mL溶液稀释到VmL,则稀释后溶液中的SO42-的物质的量浓度是(单位为mol/L)______.
(4)有一质量为mg,相对分子质量为M的某种强碱M (OH)2,在一定温度下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为ρg/cm3,则该溶液中OH- 的物质的量浓度为______,溶质的质量分数为______.
解:(1)根据n= 计算物质的量,混合气体中N2和NO的物质的量之比为
计算物质的量,混合气体中N2和NO的物质的量之比为 :
: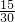 =1:1,
=1:1,
设混合气体都为1mol,则混合气体中氮原子的物质的量为3mol,氧原子的物质的量为1mol,根据N=n×NA,氮原子和氧原子的个数比为3:1,
该混合气体的平均摩尔质量为: =
= =29g/mol.
=29g/mol.
故答案为:1:1;3:1;29g/mol;
(2)根据同温同压下,物质的量与体积呈正比,气体的物质的量越多,气体的体积就越大,同温同压下,五种气体的质量相同,根据n= 计算物质的量,
计算物质的量,
由计算公式可以看出,质量相同时,物质的量与气体的摩尔质量呈反比,即摩尔质量越大,物质的量越小,
又知:①CO2②H2③O2④CH4⑤SO2的摩尔质量由大到小的顺序为:⑤SO2、①CO2、③O2、④CH4、②H2,
所以所占的体积由大到小的顺序是②④③①⑤,
根据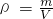 可知:密度与摩尔质量呈正比,所以,密度由大到小的顺序是⑤①③④②,
可知:密度与摩尔质量呈正比,所以,密度由大到小的顺序是⑤①③④②,
故答案为:②④③①⑤;⑤①③④②;
(3)VmL Al2(SO4)3溶液中含Al3+ag,则n(Al3+)= ,n(SO42-)=
,n(SO42-)= =
=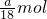 ,
,
取V/4mL溶液稀释到VmL,则稀释后溶液中的SO42-的物质的量浓度是: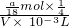 =
=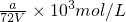
故答案为: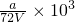 ;
;
(4)质量为mg,相对分子质量为M的某种强碱M (OH)2的物质的量为: mol,n(OH-)=
mol,n(OH-)= mol,
mol,
在一定温度下,完全溶解在水中得到VmL饱和溶液,
则该溶液中OH- 的物质的量浓度为: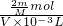 =
= mol/L,
mol/L,
若此溶液的密度为ρg/cm3,则溶液的质量为:m=ρg/ml?Vml=ρVg,
溶质的质量为:mg,
所以溶液的质量分数为: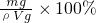 =
=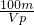 %,
%,
故答案为: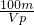 %.
%.
分析:(1)根据n= 计算物质的量,根据N=n×NA计算分子数,进而计算原子数,根据
计算物质的量,根据N=n×NA计算分子数,进而计算原子数,根据 计算平均摩尔质量;
计算平均摩尔质量;
(2)根据同温同压下,物质的量与体积呈正比判断体积关系,根据密度与摩尔质量呈正比判断密度大小顺序;
(3)根据c= 计算浓度;
计算浓度;
(4)根据质量和相对分子质量计算出碱的物质的量,根据溶液的体积计算物质的量浓度,根据溶液的质量计算质量分数.
点评:本题考查物质的量的相关计算,题目难度不大,本题注意把握物质的量与质量、体积、微粒个数等计算公式的运用.
 计算物质的量,混合气体中N2和NO的物质的量之比为
计算物质的量,混合气体中N2和NO的物质的量之比为 :
: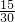 =1:1,
=1:1,设混合气体都为1mol,则混合气体中氮原子的物质的量为3mol,氧原子的物质的量为1mol,根据N=n×NA,氮原子和氧原子的个数比为3:1,
该混合气体的平均摩尔质量为:
 =
= =29g/mol.
=29g/mol.故答案为:1:1;3:1;29g/mol;
(2)根据同温同压下,物质的量与体积呈正比,气体的物质的量越多,气体的体积就越大,同温同压下,五种气体的质量相同,根据n=
 计算物质的量,
计算物质的量,由计算公式可以看出,质量相同时,物质的量与气体的摩尔质量呈反比,即摩尔质量越大,物质的量越小,
又知:①CO2②H2③O2④CH4⑤SO2的摩尔质量由大到小的顺序为:⑤SO2、①CO2、③O2、④CH4、②H2,
所以所占的体积由大到小的顺序是②④③①⑤,
根据
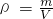 可知:密度与摩尔质量呈正比,所以,密度由大到小的顺序是⑤①③④②,
可知:密度与摩尔质量呈正比,所以,密度由大到小的顺序是⑤①③④②,故答案为:②④③①⑤;⑤①③④②;
(3)VmL Al2(SO4)3溶液中含Al3+ag,则n(Al3+)=
 ,n(SO42-)=
,n(SO42-)= =
=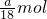 ,
,取V/4mL溶液稀释到VmL,则稀释后溶液中的SO42-的物质的量浓度是:
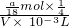 =
=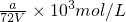
故答案为:
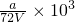 ;
;(4)质量为mg,相对分子质量为M的某种强碱M (OH)2的物质的量为:
 mol,n(OH-)=
mol,n(OH-)= mol,
mol,在一定温度下,完全溶解在水中得到VmL饱和溶液,
则该溶液中OH- 的物质的量浓度为:
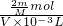 =
= mol/L,
mol/L,若此溶液的密度为ρg/cm3,则溶液的质量为:m=ρg/ml?Vml=ρVg,
溶质的质量为:mg,
所以溶液的质量分数为:
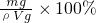 =
=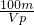 %,
%,故答案为:
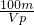 %.
%.分析:(1)根据n=
 计算物质的量,根据N=n×NA计算分子数,进而计算原子数,根据
计算物质的量,根据N=n×NA计算分子数,进而计算原子数,根据 计算平均摩尔质量;
计算平均摩尔质量;(2)根据同温同压下,物质的量与体积呈正比判断体积关系,根据密度与摩尔质量呈正比判断密度大小顺序;
(3)根据c=
 计算浓度;
计算浓度;(4)根据质量和相对分子质量计算出碱的物质的量,根据溶液的体积计算物质的量浓度,根据溶液的质量计算质量分数.
点评:本题考查物质的量的相关计算,题目难度不大,本题注意把握物质的量与质量、体积、微粒个数等计算公式的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目