题目内容
下物质间的转化通过一步化学反应不能实现的是
| A.HCl → C12 | B.Na → Na2O | C.CuO → Cu(OH)2 | D.Fe → Fe3O4 |
C
解析试题分析:A、浓盐酸与二氧化锰反应制取氯气,正确;B、钠在空气中与氧气反应得氧化钠,正确;C、氧化铜不能溶于水,不能一步制得,错误;D、铁在氧气中燃烧得四氧化三铁,正确,答案选C。
考点:考查物质的转化

练习册系列答案
相关题目
在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞。从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是
| A.NaOH与Na2CO3 | B.Na2CO3 |
| C.Na2CO3与NaHCO3 | D.NaHCO3 |
相同pH等体积的氨水和NaOH溶液,各加入5mL 0.2mol·L-1AlCl3溶液。下列判断正确的是
| A.氨水中沉淀一定比NaOH溶液中的多 |
| B.氨水中沉淀一定比NaOH溶液中的少 |
| C.氨水中沉淀可能比NaOH溶液中的多 |
| D.氨水中和NaOH溶液中的沉淀不可能一样多 |
钠铝合金(常温液态)可作核反应堆的载热介质,下列说法错误的是
| A.该合金的熔点低于金属钠的熔点 |
| B.若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Na)≥n(Al) |
| C.若将钠铝合金投入FeCl3溶液有Fe(OH)3沉淀生成 |
| D.等质量的钠铝合金中铝含量越大,与足量盐酸反应时放出的氢气越少 |
下列离子方程式中正确的是( )
| A.用FeCl3溶液腐蚀铜制印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B.NH4HCO3溶液和过量的NaOH溶液相混合:HCO3—+OH-=CO32—+H2O |
| C.向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S=FeS↓+2H+ |
| D.FeI2溶液中通入Cl2至I-恰好完全被氧化:2I-+Cl2=I2+2Cl- |
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则关于C的以下性质错误的是( )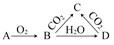
| A.溶液呈碱性 |
| B.与澄清石灰水反应产生白色沉淀 |
| C.与足量盐酸反应放出气体 |
| D.受热易分解 |
某同学研究铝及其化合物的性质时设计了如下两个实验方案。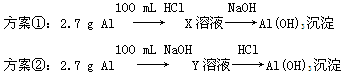
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是( )
| A.b曲线表示的是向X溶液中加入NaOH溶液 |
| B.在O点时两方案中所得溶液浓度相等 |
| C.a、b曲线表示的反应都是非氧化还原反应 |
| D.X溶液显酸性,Y溶液呈碱性 |
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。下列说法不正确的是 ( )。
| A.“联合制碱法”和“氨碱法”的化学反应原理中都有下列化学反应 NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl 2NaHCO3 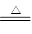 Na2CO3+H2O↑+CO2↑ Na2CO3+H2O↑+CO2↑ |
| B.“联合制碱法”生产中有氨的循环利用工艺 |
| C.“氨碱法”生产中有氨的循环利用工艺 |
| D.“联合制碱法”和“氨碱法”都有一定的局限性 |
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
| A.溶液A和B均可以是盐酸或NaOH溶液 |
| B.溶液A和B均可以选用稀硝酸 |
| C.若溶液B选用浓硝酸,则测得铜的质量分数偏小 |
| D.实验室方案Ⅱ更便于实施 |