��Ŀ����
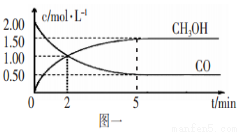
��ҵ���������ж�������Ĵ�����ԭ��Ϊ��2SO2(g)+O2(g) 2SO3(g)����Ӧ�����ϵ��ƽ��״̬ʱSO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ������˵���������
2SO3(g)����Ӧ�����ϵ��ƽ��״̬ʱSO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ������˵���������
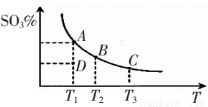
A����A��B��C����ʱ��V(��)=v(��)����D��ʱV(��)>v(��)
B��A��B��C�����ƽ�ⳣ��һ������ͬ
C�������¶ȿ��Լӿ컯ѧ��Ӧ���ʣ�������ƽ��������Ӧ�����ƶ�
D��һ���¶��£���������������䣬��ƽ����ϵ��ͨ��ϡ�����壬ѹǿ����ƽ�ⲻ�ƶ�
��ϰ��ϵ�д�
�����Ŀ



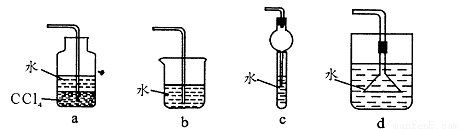


 CH3OH(g)�������Ϊ1L�ĺ����ܱ������У�����2molCO��4molH2��һ�������·���������Ӧ�����CO(g)��CH3OH(g)��Ũ����ʱ��仯��ͼһ��ʾ��
CH3OH(g)�������Ϊ1L�ĺ����ܱ������У�����2molCO��4molH2��һ�������·���������Ӧ�����CO(g)��CH3OH(g)��Ũ����ʱ��仯��ͼһ��ʾ��