题目内容
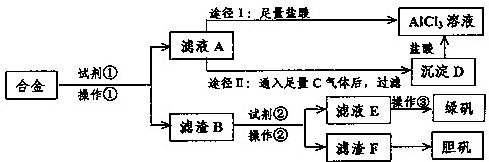
某工厂有废合金(含有铝、铁、铜)粉末,某校课外活动小组为了探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下:
试回答下列问题:
(1)所加试剂①、②分别是
(2)操作①的名称为
(3)由滤液A制AlCl3溶液有途径I和途径II两种,你认为合理的是
(4)操作③的名称是

试回答下列问题:
(1)所加试剂①、②分别是
NaOH溶液或烧碱溶液
NaOH溶液或烧碱溶液
、稀硫酸
稀硫酸
.(2)操作①的名称为
过滤
过滤
,所用的仪器除铁架台、铁圈和烧杯,还需要的器材有漏斗、玻璃棒、滤纸
漏斗、玻璃棒、滤纸
.(3)由滤液A制AlCl3溶液有途径I和途径II两种,你认为合理的是
途径II
途径II
,理由是途径I制得的AlCl3溶液中含有大量的NaCl,而途径II能制得纯净的AlCl3溶液
途径I制得的AlCl3溶液中含有大量的NaCl,而途径II能制得纯净的AlCl3溶液
.写出A→D反应离子方程式:AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3
AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3
.(4)操作③的名称是
蒸发结晶
蒸发结晶
.分析:(1)金属铝和氢氧化钠反应,而金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应而金属铜不反应;
(2)固体和液体的分离用过滤法,所用的仪器有铁架台、铁圈、烧杯、漏斗、玻璃棒、滤纸等;
(3)根据反应所得产物的组成来选择合适的制取方案;
(4)由氯化亚铁溶液获得绿矾晶体的方法是蒸发结晶.
(2)固体和液体的分离用过滤法,所用的仪器有铁架台、铁圈、烧杯、漏斗、玻璃棒、滤纸等;
(3)根据反应所得产物的组成来选择合适的制取方案;
(4)由氯化亚铁溶液获得绿矾晶体的方法是蒸发结晶.
解答:解:(1)金属铝和氢氧化钠反应,NaOH溶液或烧碱溶液后金属铝溶解其中生成偏铝酸钠溶液,金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应生成硫酸亚铁而金属铜不反应,可以实现三种金属的分离,故答案为:NaOH溶液或烧碱溶液;稀硫酸
(2)固体和液体的分离用过滤法,所用的仪器有铁架台、铁圈、烧杯、漏斗、玻璃棒、滤纸等,故答案为:过滤;漏斗、玻璃棒、滤纸;
(3)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,故答案为:途径II;途径I制得的AlCl3溶液中含有大量的NaCl,而途径II能制得纯净的AlCl3溶液;AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3;
(4)由氯化亚铁溶液获得绿矾晶体的方法是蒸发结晶,故答案为:蒸发结晶.
(2)固体和液体的分离用过滤法,所用的仪器有铁架台、铁圈、烧杯、漏斗、玻璃棒、滤纸等,故答案为:过滤;漏斗、玻璃棒、滤纸;
(3)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,故答案为:途径II;途径I制得的AlCl3溶液中含有大量的NaCl,而途径II能制得纯净的AlCl3溶液;AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3;
(4)由氯化亚铁溶液获得绿矾晶体的方法是蒸发结晶,故答案为:蒸发结晶.
点评:本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.

练习册系列答案
相关题目