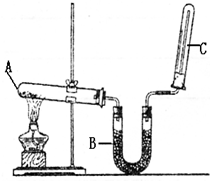
题目内容
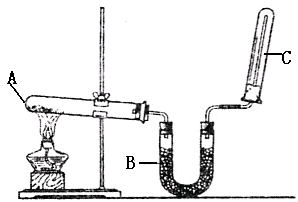 实验室用图示装置制取干燥的氨气
实验室用图示装置制取干燥的氨气(1)写出A处发生反应的化学方程式
(2)B装置内所盛药品的名称为
(3)若以a1、a2分别表示浓度为Xmol/L和Ymol/L的氨水的质量分数,且知X=2Y. 则这两种氨水质量分数的关系为
A.a1=2a2 B.2a2>a1 C.a1>2a2 D.无法确定
(4)如何检验氨气是否收集满.
分析:(1)实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气;
(2)氨气为碱性气体,用碱石灰干燥;
(3)利用c=
来计算,并利用氨水溶液的浓度越大其密度越小来分析判断;
(4)检验氨气是否集满,可以利用氨气的水溶液显碱性,即用“使湿润的红色石蕊试纸变蓝”;也可以用氨气遇浓盐酸产生白烟,即“用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟”;
(2)氨气为碱性气体,用碱石灰干燥;
(3)利用c=
| 1000ρw |
| M |
(4)检验氨气是否集满,可以利用氨气的水溶液显碱性,即用“使湿润的红色石蕊试纸变蓝”;也可以用氨气遇浓盐酸产生白烟,即“用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟”;
解答:解:(1)实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,反应的化学方程式为Ca(OH)2+2NH4Cl═CaCl2 +2H2O+2 NH3↑,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;
(2)制备氨气反应过程中会产生水,使氨气中混有水蒸气,U形管只能盛装固体干燥剂,可用碱石灰吸收水蒸气,但是不能用氯化钙和无水硫酸铜,因为它们均与氨气反应,
故答案为:碱石灰;
(3)以a1、a2分别表示浓度为Xmol/L和Ymol/L的氨水的质量分数,则X=
,Y=
,
且知X=2Y,则
=2×
,即ρ1a1=2ρ2a2,
又氨水溶液的浓度越大其密度越小,则ρ1<ρ2,即a1>2a2,
故答案为:C;
(4)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时将湿润的红色石蕊试纸置于试管口外,若变蓝则收集满,也可以用氨气遇浓盐酸产生白烟,即“用蘸有浓盐酸的玻璃棒放在管口,产生白烟”,则收集满,
故答案为:用蒸馏水将红色石蕊试纸沾在玻璃棒上,靠近收集试管的管口,如果试纸变蓝,则说明已收集满或用玻璃棒蘸浓盐酸靠近收集试管的管口,如果观察到有白烟产生也可说明收集满.
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)制备氨气反应过程中会产生水,使氨气中混有水蒸气,U形管只能盛装固体干燥剂,可用碱石灰吸收水蒸气,但是不能用氯化钙和无水硫酸铜,因为它们均与氨气反应,
故答案为:碱石灰;
(3)以a1、a2分别表示浓度为Xmol/L和Ymol/L的氨水的质量分数,则X=
| 1000ρ1a1 |
| 17 |
| 1000ρ2a2 |
| 17 |
且知X=2Y,则
| 1000ρ1a1 |
| 17 |
| 1000ρ2a2 |
| 17 |
又氨水溶液的浓度越大其密度越小,则ρ1<ρ2,即a1>2a2,
故答案为:C;
(4)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时将湿润的红色石蕊试纸置于试管口外,若变蓝则收集满,也可以用氨气遇浓盐酸产生白烟,即“用蘸有浓盐酸的玻璃棒放在管口,产生白烟”,则收集满,
故答案为:用蒸馏水将红色石蕊试纸沾在玻璃棒上,靠近收集试管的管口,如果试纸变蓝,则说明已收集满或用玻璃棒蘸浓盐酸靠近收集试管的管口,如果观察到有白烟产生也可说明收集满.
点评:本题考查氨气的实验室制法,掌握氨气的性质是解答本题的关键,(3)两种氨水质量分数比较为该题的难点,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯.
 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯.