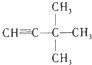
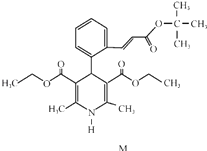
题目内容
【题目】运用化学反应原理分析解答以下问题
(1)已知:①CO(g)+2H2(g)CH3OH(g)△Hl=﹣91kJmol﹣l
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣24kJmol﹣l
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41kJmol﹣l
且三个反应的平衡常数依次为K1、K2、K3
则反应 3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H= .
化学平衡常数K=(用含K1、K2、K3的代数式表示).
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),下列能说明反应达到平衡状态是 .
a.体系压强保持不变
b.混合气体密度保持不变
c.CO和H2的物质的量保持不变
d.CO的消耗速度等于CO2的生成速率
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3 . 其电池反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显(填“酸性”、“中性”、“碱性”),写出正极的电极反应方程式 .
【答案】
(1)﹣247kJ?mol﹣1;K=K12?K2?K3
(2)ac
(3)碱性;O2+2H2O+4e﹣=4OH﹣
【解析】解:(1)利用盖斯定律,反应①×2+反应②+反应③,得到目的反应,△H=﹣91kJmol﹣1+(﹣24kJmol﹣1)+(﹣41kJmol﹣1)=﹣247kJmol﹣1 ,
反应①×2+反应②+反应③相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K12K2K3 , 所以答案是:﹣247kJmol﹣1; K=K12K2K3;(2)a、反应前后气体体积不同,当压强一定时,达到化学平衡状态,故a正确;b、 ![]() ,体系体积一定,反应前后气体质量相同,密度始终不变,不能判断是否平衡,故b错误;c、CO和H2的物质的量保持不变,则其他各物质浓度亦保持不变,达到化学平衡状态,故c正确;d、CO的消耗速率等于CO2的生成速率,均为正反应方向,不能判断是否平衡,故d错误;故选ac;(3)因NH3能与水反应,所以溶液呈碱性,因正极得到电子化合价升高,所以电极反应为:O2+2H2O+4e﹣=4OH﹣ , 所以答案是:碱性;O2+2H2O+4e﹣=4OH﹣ .
,体系体积一定,反应前后气体质量相同,密度始终不变,不能判断是否平衡,故b错误;c、CO和H2的物质的量保持不变,则其他各物质浓度亦保持不变,达到化学平衡状态,故c正确;d、CO的消耗速率等于CO2的生成速率,均为正反应方向,不能判断是否平衡,故d错误;故选ac;(3)因NH3能与水反应,所以溶液呈碱性,因正极得到电子化合价升高,所以电极反应为:O2+2H2O+4e﹣=4OH﹣ , 所以答案是:碱性;O2+2H2O+4e﹣=4OH﹣ .
【考点精析】掌握化学平衡常数的含义和化学平衡状态的判断是解答本题的根本,需要知道指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态;状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
阴离子 | OH﹣ Cl﹣ CO32﹣ NO3﹣ SO4﹣ |
分别取它们的水溶液进行实验,结果如下:①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3 , 沉淀部分溶解,剩余白色固体;②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6molL﹣1稀H2SO4 , Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:A;C .
(2)写出步骤②中发生反应的化学方程式 .
(3)D溶液中滴入石蕊试液,现象是 , 原因是(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是mL.
(5)现用500mL 3molL﹣1的E溶液充分吸收11.2L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为 .
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水).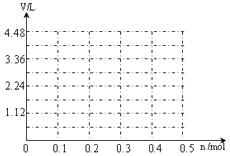
【题目】在呼吸面具和潜水艇中可用过氧化钠作供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
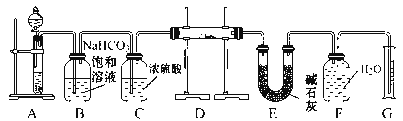
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:____________________。
(2)B、C、E均为除杂装置(U型管中加固体干燥剂)除杂顺序如表:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | 浓硫酸 | _________ |
E | 碱石灰 | _________ |
(3)写出B中发生反应的离子方程式:__________________________________。
(4)写出D中过氧化钠与二氧化碳反应的化学方程式:__________________。
(5)试管F中收集满气体后,证明试管中收集的气体是氧气的实验操作是:_____。