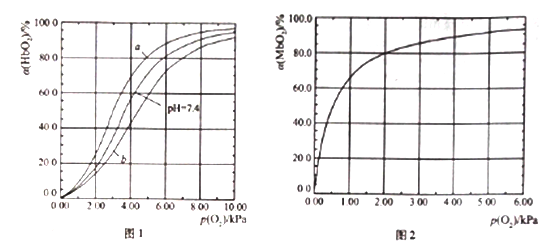
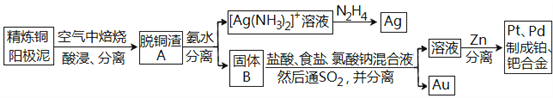
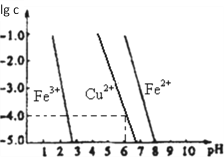
题目内容
【题目】碳、硅元素的单质及其化合物是构成自然界的重要物质.
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:
CH3COONa+NaOH ![]() CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于晶体(填晶体类型);
②MgO晶体的熔点比CaO高,主要原因是 .
(2)C60、金刚石和石墨是三种重要的碳单质,结构模型分别如图所示(其中石墨仅表示出其中的一层结构). 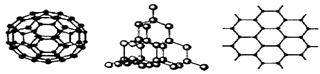
①金刚石中碳原子的杂化方式为;
②石墨层状结构中,平均每个正六边形占有的C﹣C键数是个.
【答案】
(1)离子;Mg2+半径比Ca2+小,因此MgO晶体的晶格能较大,熔点较高
(2)sp3;3
【解析】解:(1.)①根据元素守恒及原子守恒知,X是碳酸钠,碳酸钠是由阴阳离子构成的离子晶体;所以答案是:离子;②MgO晶体的熔点比CaO高都属于离子晶体,Mg2+半径比Ca2+小,键能较大,所以氧化镁晶体的晶格能大于氧化钙,导致氧化镁晶体的熔点大于氧化钙,所以答案是:Mg2+半径比Ca2+小,因此MgO晶体的晶格能较大,熔点较高;
(2.)①金刚石中每个碳原子和4个碳原子以σ键相结合,且没有孤对电子,所以每个碳原子的价层电子对是4,则碳原子采取sp3杂化,所以答案是:sp3;②石墨层状结构中,每个碳原子被三个正六边形共用,所以平均每个正六边形占有的碳原子数=6× ![]() 3;所以答案是:3.
3;所以答案是:3.

练习册系列答案
相关题目